
100mL浓度为2mol·L-1的盐酸溶液跟过量的锌片反应,为减慢反应速率,又不影响生成H2的总量,可采用的方法有
A.加适量6mol·L-1HCl溶液
B.加数滴CuCl2溶液
C.加适量醋酸钠固体
D.加适量NaNO3溶液
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源:2014-2015江西省新余市高一上学期期末考试化学试卷(解析版) 题型:选择题
两种金属组成的合金5.0g,与足量氯气反应,共用去0.1mol氯气,则该合金可能的组成是
A.钙和铜 B.锌和铜 C.钠和铝 D.铝和铁
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省日照市高三3月模拟考试理综化学试卷(解析版) 题型:选择题
某无色溶液中只可能含有Na+、Ba2+、Cl-、Br-、SO32-、SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:

下列结论正确的是
A.肯定含有离子的Na+、Br-、SO32- B.肯定没有的离子是Ba2+、SO32-
C.可能含有的离子是Cl-、Br-、SO42- D.不能确定的离子是Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
对下列叙述的评价合理的是:
选项 | 叙述 | 评价 |
A | 乙酸乙酯在H218O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有。 |
B | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性。 |
C | 用酸性高锰酸钾溶液除去甲烷中的乙烯气体 | 对,乙烯能与酸性高锰酸钾溶液反应,而甲烷不能与高锰酸钾溶液反应。 |
D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液。 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
在密闭容器中,对于可逆反应A+3B  2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是

A.若正反应方向△H <0,则T1> T 2
B.压强增大时,混合气体的密度减小
C.A一定为气体
D.B一定为气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2。有关它们的叙述 ①与水反应都是氧化还原反应;②与水反应后的溶液都显碱性;③与盐酸反应都只生成一种盐;④两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
A.①②③④ B.①②③ C.②③ D.②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
下列化学用语描述中不正确的是
A.中子数为20的氯原子: Cl
Cl
B.比例模型 可以表示CO2 分子或SiO2分子
可以表示CO2 分子或SiO2分子
C.HCO 的电离方程式为:HCO
的电离方程式为:HCO + H2O
+ H2O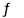 CO
CO +H3O+
+H3O+
D.次氯酸的结构式:H-O-Cl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三3月月考理综化学试卷(解析版) 题型:填空题
(15分)元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的 ,处理该废水常用直接沉淀法或还原沉淀法。
,处理该废水常用直接沉淀法或还原沉淀法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡: 。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 。
。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 。
Ⅱ,还原沉淀法

(2)下列溶液中可以代替上述流程中 溶液的是 (填选项序号)。
溶液的是 (填选项序号)。
A.FeSO4溶液 B.浓H2SO4溶液
C.酸性KMnO4溶液 D.Na2SO3溶液
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为 。
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示: 。
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
①阳离子交换树脂的原材料质疑是聚苯乙烯,其单体为苯乙烯( ),聚苯乙烯的化学式为 。
),聚苯乙烯的化学式为 。
②某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:选择题
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2) :n(NO)=1 :1时,下列说法不正确的是
A.反应中Cu2S是还原剂,Cu(NO3)2、CuSO4是氧化产物
B.参加反应的n(Cu2S) :n(HNO3)=1 :7
C.产物n[Cu(NO3)2] :n[CuSO4]=1 :2
D.1 molCu2S参加反应时有10 mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com