
【题目】某化学研究性学习小组探究Fe3+和SO![]() 之间发生的反应。
之间发生的反应。
(1)取5 mL FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。这种红褐色液体是_________。
(2)除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为________________________。
(3)研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
(方案一)检验溶液中含有Fe2+证明发生了氧化还原反应
(方案二)检验溶液中含有____证明发生了氧化还原反应
实验用品:0.1 mol·L-1 BaCl2、3 mol·L-1 盐酸、3 mol·L-1 硝酸、新制氯水、20% KSCN、0.5 mol·L-1 KI;试管若干、胶头滴管若干。
Ⅰ.预处理:将(1)中获得的混合物放在如图装置中处理足够时间,该操作名称为____。

Ⅱ.检验过程
①简述证明溶液中含有Fe2+的操作方法:_________________________________________;
②检验溶液中含有另一种离子可选用的试剂是:_______________________。
【答案】Fe(OH)3胶体SO32-+2Fe3++H2O===2Fe2++SO42-+2H+SO42-渗析取适量烧杯中的溶液于试管中,滴加2~3滴20% KSCN溶液,没有明显变化,再加入足量氯水(或3 mol/L硝酸),溶液变血红色,证明溶液中含有Fe2+3 mol·L-1 盐酸、0.1 mol·L-1 BaCl2
【解析】
(1)FeCl3是强酸弱碱盐,水解使溶液显酸性; Na2SO3是强碱弱酸盐水解使溶液显碱性。当二者混合时,对彼此的水解起到了促进作用,所以产生了红褐色的氢氧化铁胶体。(2)如果二者混合发生氧化还原反应,则反应的方程式是:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+。在该反应中氧化剂Fe3+生成还原产物Fe2+;还原剂SO32-氧化为氧化产物SO42-。所以证明发生了氧化还原反应可以通过检验溶液中含有Fe2+或检验溶液中含有SO42-。提纯胶体的方法是渗析;方案一:利用Fe3+遇到SCN-产生血红色溶液,而Fe2+遇到SCN-不会发生反应,Fe2+遇到氯水被氧化为Fe3+后产生血红色溶液来检验溶液中含有Fe2+。方案二:向溶液中加入足量3mol/L的盐酸使SO32-转化为SO2气体,再滴加0.1mol/L BaCl2溶液,若产生白色沉淀,就证明含有SO42-。
(1)FeCl3是强酸弱碱盐,水解使溶液显酸性; Na2SO3是强碱弱酸盐水解使溶液显碱性。当二者混合时,对彼此的水解起到了促进作用,产生了红褐色的氢氧化铁胶体,所以红褐色液体是氢氧化铁胶体。(2)如果二者混合发生氧化还原反应,Fe3+被还原为Fe2+、SO32-被氧化为SO42-,则反应的离子方程式是:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+。(3)在该反应中还原产物Fe2+、氧化产物SO42-。所以证明发生了氧化还原反应可以通过检验溶液中含有Fe2+或检验溶液中含有SO42-。Ⅰ.提纯胶体的操作名称是渗析。Ⅱ. ①证明溶液中含有Fe2+的操作方法是:取适量烧杯中的溶液于试管中,滴加2~3滴20% KSCN溶液,没有明显变化,再加入足量氯水(或3 mol/L硝酸),溶液变血红色,证明溶液中含有Fe2+;②检验溶液中含有SO42-的方法是:向溶液中加入足量3mol/L的盐酸使SO32-转化为SO2气体,再滴加0.1mol/L BaCl2溶液,若产生白色沉淀,就证明含有SO42-,所以可选用的试剂是:3 mol·L-1 盐酸、0.1 mol·L-1 BaCl2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列说法 一定正确的是( )

A. 一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42﹣、Fe3+
B. 一定存在H+、Al3+、NH4+、SO42﹣,可能存在Na+、Mg2+
C. 溶液中c(H+):c(Al3+):c(Mg2+)为1:1:2
D. 溶液中c(H+)/c(SO42﹣)比值小于等于2/9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多酶片中含有的蛋白酶、淀粉酶、脂肪酶具有辅助消化的作用。下列关于酶的叙述正确的是
A.多酶片中酶的基本组成单位是氨基酸
B.酶的数量因参与化学反应而减少
C.酶提供化学反应开始时所必需的活化能
D.酶在生物体内才起催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质 ( )

A. A是C3H8;B是C6H6 B. A是C4H10;B是C6H6
C. A是C3H6;B是C3H6 D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,化合物![]() 的名称为2,4﹣二乙基﹣6﹣丙基辛烷
的名称为2,4﹣二乙基﹣6﹣丙基辛烷
B. 月桂烯(![]() )所有碳原子一定在同一平面上
)所有碳原子一定在同一平面上
C. 甲苯能使溴水和KMnO4溶液褪色
D. HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. Cu![]() CuS
CuS ![]() CuCl2
CuCl2
B. NaCl ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
C. Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
D. MgCO3![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯是由苯环和甲基结合而成的,甲苯能够使酸性KMnO4溶液褪色是因为
A. 烷烃能使酸性KMnO4溶液褪色B. 苯环能使酸性KMnO4溶液褪色
C. 苯环使甲基的活性增强而导致的D. 甲基使苯环的活性增强而导致的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有SiO32—、OH—、CO32—、SO42—、AlO2—、HCO3—、Na+、Mg2+、Fe3+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是
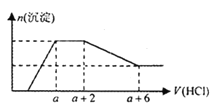
A.原溶液中一定含有Na2SO4
B.反应最后形成的溶液中的溶质只有NaCl
C.原溶液中含有CO32- 与AlO2- 的物质的量之比为1∶2
D.原溶液中一定含有的阴离子是:OH—、CO32—、SiO32—、AlO2—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)在恒温、恒容条件下,能说明可逆反应:H2(g)+I2(g) 2HI(g)达到平衡状态的是
A. 气体的压强保持不变 B. v(H2)正=2v(HI)逆
C. 气体的密度保持不变 D. 气体的颜色保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com