
【题目】下列金属的冶炼方法正确的是( )
A.电解氯化钠溶液冶炼金属钠
B.电解熔融的氯化铝冶炼金属铝
C.将铁粉与氧化镁混合加热冶炼镁
D.用一氧化碳还原氧化铁冶炼铁
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】用铁片与稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是( )
A.给该反应体系适当加热
B.向反应体系中加水稀释
C.向反应体系中加入适量浓盐酸
D.将铁片换成铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)写出E元素名称:________
(2)C基态原子的电子排布图为___________________,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于________键(填“σ”或“π”)。
(3)当n=2时,BC分子的结构式是 ________;当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是______________。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序是__________________(用元素符号表示)。
(5)E元素原子的价电子排布式是________,在元素周期表中位置是______________,其最高价氧化物的化学式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。
请回答:
(1)已知:2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3 351 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·mol-1
2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是________________________,
该反应自发进行的条件________。
(2)在常压、Ru/TiO2催化下,CO2和H2混合气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
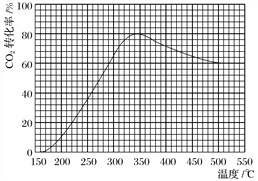
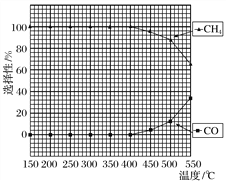
图1 图2
①下列说法不正确的是________。
A.ΔH4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350 ℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为________(用a、V表示)。
③350 ℃下CH4物质的量随时间的变化曲线如图3所示。画出400 ℃下0~t1时刻CH4物质的量随时间的变化曲线。__________________________
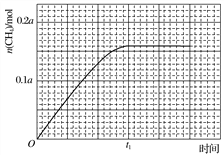
图3
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如右图所示。下列说法正确的是( )

A. 稀释前的HA和HB溶液分别与等物质的量的NaOH恰好反应,消耗酸的体积:V(HA)>V(HB)
B. a点溶液的导电性比c点溶液的导电性弱
C. HB是强酸
D. a、b两点溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.Al3+、K+、OH﹣、NO3﹣
B.Ba2+、Na+、SO42﹣、OH﹣
C.H+、K+、CH3COO﹣、Cl﹣
D.K+、Na+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无机矿物资源生产部分材料,其产品流程示意图如下,下列说法正确的是( )

A. 制取粗硅时生成的气体产物为CO2
B. 生产铝、铜、高纯硅及玻璃的过程中都涉及氧化还原反应
C. 电解精炼铜时,当电路中转移0.2mol电子时阳极质量减轻6.4g
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在水溶液中能够大量共存的是
A. H+、SO42-、SO32- B. Ba2+、CO32-、NO3-
C. Mg2+、Cl-、SO42- D. Ca2+、OH -、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数的数值,下列叙述正确的是
A. 标准状况下,22.4LCCl4含有分子数为1 NA
B. 常温常压下,1.42g Na2SO4含的有的Na+离子数为0.01 NA
C. 标准状况下,1.5 NA 个CO2分子占有的体积约为33.6L
D. 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl- 个数为2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com