
【题目】如图所示装置进行实验,下列有关说法正确的是( )
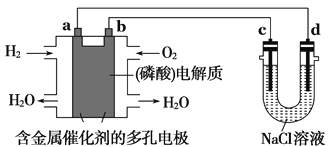
A. 电子流向为:电极a → 电极d →电极c →电极b
B. 电极b发生的电极反应为O2 + 2H2O + 4e- = 4OH-
C. 在电极a参与反应的气体体积在相同状况下与在电极c产生的气体体积为1:1
D. 为了防止大气污染,应在d端的U形管出口连接导管通入到NaOH溶液中
【答案】C
【解析】左边为氢氧燃料电池,磷酸为电解质,通入氢气的一极a极为负极,通入氧气的一极b极为正极,右边为电解氯化钠溶液的电解池,连接正极的c极为阳极,连接负极的d极为阴极。A. 电子流向为:电极a→电板d,电极c→电极b,电子不能在溶液中流动,选项A错误;B. 电极b为正极,酸性条件下氧气得电子与氢离子反应生成水,发生的电极反应为O2+4H++4e-=2H2O,选项B错误;C. 根据得失电子守恒,在电极a参与反应的气体氢气体积在相同状况下与在电极c产生的气体氯气体积为1:1,选项C正确;D. c端产生氯气,为了防止大气污染,应在c端的U形管口连接导管通入到NaOH溶液中吸收氯气,选项D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:①CH![]() (g)+1/2O
(g)+1/2O![]() (g)══CO(g)+2H
(g)══CO(g)+2H![]() (g) ΔH1=-35.6kJ·mol
(g) ΔH1=-35.6kJ·mol![]() ,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
,试判断常温下,上述反应能否自发进行:___________(填”能”或”否”)。
有研究认为甲烷部分氧化的机理为:
②CH![]() (g)+2O
(g)+2O![]() (g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol
(g)=CO2(g)+2H2O(g) ΔH2=-890.3kJ·mol![]() ;
;
③CH![]() (g)+CO
(g)+CO![]() (g)=2CO(g)+2H
(g)=2CO(g)+2H![]() (g) ΔH3=+247.3kJ·mol
(g) ΔH3=+247.3kJ·mol![]() ,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
,请结合以上三个反应与条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:________________________________。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为_______________。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
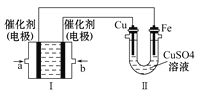
①b处电极上发生的电极反应式是_____________________________。
②电镀结束后,装置Ⅰ中溶液的pH___________(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu![]() 的物质的量浓度___________________。
的物质的量浓度___________________。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷_________L (标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是合成抗痛风药非布司他的一种中间体,其合成路线如下图所示:
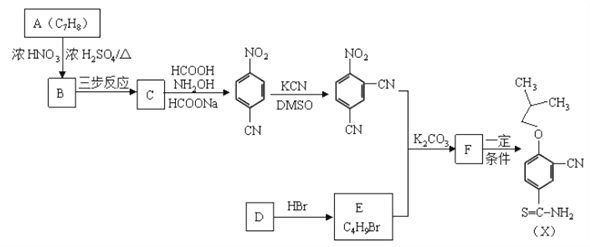
已知: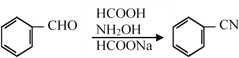
(1)A是一种重要的化工原料和有机溶剂,其结构简式是________。
(2)A![]() B的反应类型是________。
B的反应类型是________。
(3)C中所含的官能团是________。
(4)B![]() C可通过三步反应完成,请选择必要的无机试剂完成该转化,写出有关反应的化学方程式________、________、________。
C可通过三步反应完成,请选择必要的无机试剂完成该转化,写出有关反应的化学方程式________、________、________。
(5)D是一种烃,D![]() E时可能产生的副产物结构简式是________。
E时可能产生的副产物结构简式是________。
(6)F与![]() 在一定条件下反应生成X,写出F的结构简式________。
在一定条件下反应生成X,写出F的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
![]()
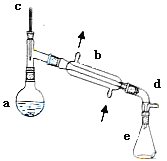
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________。
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________。(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________。
(4)在本实验的分离过程中,产物应从分液漏斗的____________。(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是____________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。(填正确答案标号)
A.圆底烧瓶 B.温度计 C.吸滤器 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________。(填正确答案标号)
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

⑴氯化水解法生产三氯氧磷的化学方程式为______。
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取ag产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是______(选填字母),滴定终点的现象为______。
a.NH4Fe(SO4)2 b.FeCl2 c.甲基橙 d.淀粉
②实验过程中加入硝基苯的目的是_____________________,如无此操作所测Cl元素含量将会______(填“偏大”、“偏小”或“不变”)
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是_________________。
②下图是不同条件对磷的沉淀回收率的影响图像。
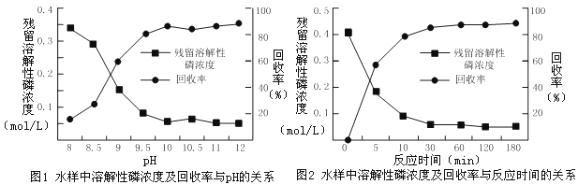
处理该厂废水最合适的工艺条件为______(选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7mol·L-1,溶液中c(Ca2+)=__________mol·L-1。
(已知Ksp[Ca3(PO4)2]=2×10-29)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应H2(g) + I2(g) ![]() 2HI(g)达到平衡的标志是 ( )
2HI(g)达到平衡的标志是 ( )
A. H2、I2、HI的浓度相等 B. H2、I2、HI的浓度保持不变
C. 混合气体的密度保持不变 D. 混合气体的体积保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近美国科学家实施了一项“天空绿色计划”,通过电解二氧化碳得到碳材料(部分原理如图所示),并利用得到的碳材料生成锂离子电池。下列说法正确的是

A. 图中能量转化方式只有一种
B. 阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑
C. 若反应中转移1mole-,则理论上消耗CO32-0.5mol
D. 当生成12g碳材料时,可收集到22.4LO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com