
(10分)电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板蚀刻液。某探究小组设计如下线路处理废液和资源回收:

请回答:
(1)FeCl3—HCl溶液蚀刻铜板后的废液中含有的金属阳离子是 。
(2)FeCl3蚀刻液中加入盐酸的目的:可以 ,又可提高蚀刻速率。
(3)步骤①中加入H2O2溶液的目的是 。
(4)已知:生成氢氧化物沉淀的pH
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是 。
(5)写出步骤②中生成CO2的一个离子方程式_____(已知Cu2(OH)2CO3不易溶于水)。
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式___________________。
(共10分)
(1)Fe3+ 、Fe2+和Cu2+ (2分,写对3个得2分,少一个得一分)
(2)抑制氯化铁水解 (1分)
(3)将Fe2+氧化成Fe3+,方便后续沉淀时除去(1分)
(4)[3.2,4.7)或3.2≤pH<4.7
(5)4H++Cu2(OH)2CO3 = 3H2O +2 Cu2++ CO2↑
或4Fe3++3Cu2(OH)2CO3+3H2O = 4Fe(OH)3+6 Cu2++3 CO2↑
(6)2Cu2++4HCO3— = Cu2(OH)2CO3↓+H2O +3 CO2↑
【解析】
试题分析:(1)由2Fe3++Cu=2Fe2++Cu2+可知,溶液蚀刻铜板后的废液中含有的金属阳离子是Fe3+ 、Fe2+和Cu2+;(2)为了防止Fe3+的水解,蚀刻液中加入盐,又可提高蚀刻速率;(3)由生成氢氧化物沉淀的pH表可知Fe3+比Fe2+更易沉淀而除去,所以在步骤①中加入H2O2溶液将Fe2+氧化成Fe3+,方便后续沉淀时除去;(4)根据表中数据为了让Fe3+完全沉淀,pH应该大于等于3.2,为了防止Fe2+、Cu2+沉淀,pH小于4.7,所以pH的范围是[3.2,4.7)或3.2≤pH<4.7;(5)由Cu2(OH)2CO3不易溶于水,可写出生成二氧化碳的方程式为4H++Cu2(OH)2CO3 = 3H2O +2 Cu2++ CO2↑或4Fe3++3Cu2(OH)2CO3+3H2O = 4Fe(OH)3+6 Cu2++3 CO2↑;(6)步骤③生成Cu2(OH)2CO3的离子方程式2Cu2++4HCO3— = Cu2(OH)2CO3↓+H2O +3 CO2↑。
考点:铁及其化合物性质
考点分析: 考点1:溶解平衡 考点2:离子浓度比较 考点3:物质的制备 试题属性

科目:高中化学 来源:2014-2015学年山东省日照市高三3月模拟考试理综化学试卷(解析版) 题型:选择题
某无色溶液中只可能含有Na+、Ba2+、Cl-、Br-、SO32-、SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:

下列结论正确的是
A.肯定含有离子的Na+、Br-、SO32- B.肯定没有的离子是Ba2+、SO32-
C.可能含有的离子是Cl-、Br-、SO42- D.不能确定的离子是Na+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州五校高三上学期摸底联考化学试卷(解析版) 题型:选择题
下列化学用语描述中不正确的是
A.中子数为20的氯原子: Cl
Cl
B.比例模型 可以表示CO2 分子或SiO2分子
可以表示CO2 分子或SiO2分子
C.HCO 的电离方程式为:HCO
的电离方程式为:HCO + H2O
+ H2O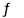 CO
CO +H3O+
+H3O+
D.次氯酸的结构式:H-O-Cl
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三3月月考理综化学试卷(解析版) 题型:填空题
(15分)元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境。电镀厂产生的镀铜废水中往往含有一定量的 ,处理该废水常用直接沉淀法或还原沉淀法。
,处理该废水常用直接沉淀法或还原沉淀法。
I.直接沉淀法
(1)已知含铬废水中存在着平衡: 。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 。
。在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成沉淀的化学式为 。
Ⅱ,还原沉淀法

(2)下列溶液中可以代替上述流程中 溶液的是 (填选项序号)。
溶液的是 (填选项序号)。
A.FeSO4溶液 B.浓H2SO4溶液
C.酸性KMnO4溶液 D.Na2SO3溶液
(3)上述流程中,每消耗0.1molNa2S2O3转移0.8mole-,则加入Na2S2O3溶液时发送反应的离子方程式为 。
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,原因可用离子方程式表示: 。
(5)实际工业生产中有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。
①阳离子交换树脂的原材料质疑是聚苯乙烯,其单体为苯乙烯( ),聚苯乙烯的化学式为 。
),聚苯乙烯的化学式为 。
②某次测定过程中,将pH=5的废水经过阳离子交换树脂后,测的溶液中Na+比交换前增加了4.6×10-2g/L,则该条件下Cr(OH)3的Ksp的值为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省福州市高三3月月考理综化学试卷(解析版) 题型:选择题
下列关于乙酸说法错误的是
A.乙酸与甲酸甲酯(HCOOCH3)互为同分异构体
B.乙酸与乙醇都能与Na反应,生产H2
C.加入生石灰再蒸馏可以除去冰醋酸中少量的水
D.饱和Na2CO3溶液可除去乙酸乙酯中少量的乙酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市石景山区高三上学期期末考试化学试卷(解析版) 题型:选择题
下列比较中,正确的是
A.原子半径:Na>Mg B.碱性:NaOH>KOH
C.结合H+的能力:CO32<Cl D.还原性:I<Br
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三第一次模拟考试化学试卷(解析版) 题型:选择题
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2) :n(NO)=1 :1时,下列说法不正确的是
A.反应中Cu2S是还原剂,Cu(NO3)2、CuSO4是氧化产物
B.参加反应的n(Cu2S) :n(HNO3)=1 :7
C.产物n[Cu(NO3)2] :n[CuSO4]=1 :2
D.1 molCu2S参加反应时有10 mol电子转移
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省文登市高三第二次统考理科综合化学试卷(解析版) 题型:选择题
如图X、Y、A、B、C均为短周期主族元素,其中只有一种是金属元素,则下列说法错误是
X | A | ||
Y | C | B |
A.原子半径大小:Y > C > X > A
B.Y和B形成的化合物中Y和B的原子个数比为2:3
C.X、C、A中最高价氧化物对应的水化物的酸性最强的是A
D.A、B均为非金属元素,所以两者的氢化物相遇不发生反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com