
【题目】醇酸树脂是一种成膜性好的树脂,如图是一种醇酸树脂的合成线路:

已知:![]()
![]()
![]() 反应①的化学方程式是______.
反应①的化学方程式是______.
![]() 写出B的结构简式是______.
写出B的结构简式是______.
![]() 反应①~③中属于取代反应的是______
反应①~③中属于取代反应的是______![]() 填序号
填序号![]() .
.
![]() 反应④的化学方程式为是______.
反应④的化学方程式为是______.
![]() 反应⑤的化学方程式是______.
反应⑤的化学方程式是______.
![]() 下列说法正确的是______
下列说法正确的是______![]() 填字母
填字母![]() .
.
a B存在顺反异构
b 1molE与足量的银氨溶液反应能生成2mol![]()
c F能与![]() 反应产生
反应产生![]()
d丁烷、![]() 丙醇和D中沸点最高的为丁烷
丙醇和D中沸点最高的为丁烷
![]() 写出符合下列条件的与
写出符合下列条件的与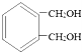 互为同分异构体的结构简式______.
互为同分异构体的结构简式______.
![]() 能与浓溴水反应生成白色沉淀
能与浓溴水反应生成白色沉淀![]() 苯环上一氯代物有两种
苯环上一氯代物有两种![]() 能发生消去反应.
能发生消去反应.
【答案】![]()
![]()
![]()
![]()
![]()
![]() +O2
+O2![]()
![]() +2H2O
+2H2O  c
c 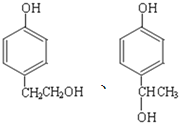
【解析】
由题中各物质的转化关系可知,![]() 在氢氧化钠乙醇溶液中发生消去反应生成A为
在氢氧化钠乙醇溶液中发生消去反应生成A为![]() ,
,![]() 在NBS作用之下生成B为
在NBS作用之下生成B为![]() ,
,![]() 与
与![]() 生成C为
生成C为![]() ,
,![]() 再碱性水解生成D为
再碱性水解生成D为![]() ,根据
,根据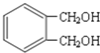
![]()
 ,结合反应条件可知,E为
,结合反应条件可知,E为 ,F为
,F为 ,据此来解题即可。
,据此来解题即可。
![]() 反应①的化学方程式为
反应①的化学方程式为![]() ;
;
![]() 根据上面的分析可知,B的结构简式是
根据上面的分析可知,B的结构简式是![]() ;
;
![]() 根据上面的分析可知,反应①为消去反应,反应②为加成反应,反应③为取代反应
根据上面的分析可知,反应①为消去反应,反应②为加成反应,反应③为取代反应![]() 或水解反应
或水解反应![]() ,答案为③;
,答案为③;
![]() 反应④的化学方程式为
反应④的化学方程式为 ;
;
![]() 反应⑤的化学方程式是
反应⑤的化学方程式是 ;
;
![]() 为
为![]() ,在碳碳双键上的一个碳上有两个原子都是氢,所以不存在顺反异构,故a错误;
,在碳碳双键上的一个碳上有两个原子都是氢,所以不存在顺反异构,故a错误;
![]() 为
为 ,1mol E与足量的银氨溶液反应能生成4mol Ag,故b错误;
,1mol E与足量的银氨溶液反应能生成4mol Ag,故b错误;
![]() 中有羧基,能与
中有羧基,能与![]() 反应产生
反应产生![]() ,故c正确;
,故c正确;
![]() 丁烷、
丁烷、![]() 丙醇和
丙醇和![]() 中沸点最高的为
中沸点最高的为![]() ,故d错误;
,故d错误;
答案选c;
![]() 符合下列条件
符合下列条件![]() 能与浓溴水反应生成白色沉淀,说明有酚的结构,
能与浓溴水反应生成白色沉淀,说明有酚的结构,![]() 苯环上一氯代物有两种,
苯环上一氯代物有两种,![]() 能发生消去反应,与
能发生消去反应,与 互为同分异构体,这样的结构有
互为同分异构体,这样的结构有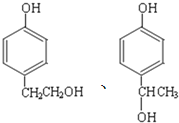 ,共2种。
,共2种。


科目:高中化学 来源: 题型:
【题目】(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是________________。
(2)A元素原子L层上有6个电子,B元素比A元素原子核外电子层数多1,B元素原子最外电子层只有1个电子。
①B元素的原子结构示意图________________。
②A、B两元素形成的化合物化学式是______________,该化合物与CO2反应的化学方程式是________________________。
(3)已知某粒子的结构示意图为 ,试回答:
,试回答:
①当x-y=10时,该微粒为__________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,常见的微粒可能为(填元素符称)____________、____________、____________、K+、____________。
③写出y=3与y=7的元素最高价氧化物对应水化物之间发生反应的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示。则下列对该反应的推断合理的是( )

A.该反应的化学方程式为6A+2D![]() 3B+4C
3B+4C
B.0~1s内, v(A)=v(B)
C.0~5s内,B的平均反应速率为006mol·L-1·s-1
D.5s时,v(A)=v(B)=v(C)=v(D)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z是合成某种抗结核候选药物的重要中间体,可由下列反应制得。
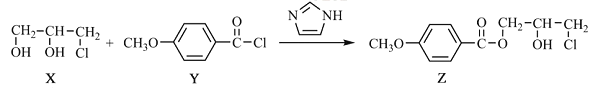
下列有关化合物X、Y和Z的说法正确的是
A.X分子中不含手性碳原子
B.Y分子中的碳原子一定处于同一平面
C.Z在浓硫酸催化下加热可发生消去反应
D.X、Z分别在过量NaOH溶液中加热,均能生成丙三醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4与CO2重整生成H2和CO的过程中主要发生下列反应
![]()
![]()
在恒压、反应物起始物质的量比![]() 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是
条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是

A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置制备溴苯,下列说法错误的是

A. 装置A中长玻璃导管仅起冷凝回流作用,装置B中的实验现象是CCl4由无色变橙色
B. 若装置B后连接装置C,装置C中生成淡黄色沉淀,可证明装置A中发生取代反应
C. 若装置B后连接装置D,则装置D的作用是吸收尾气
D. 向反应后的装置A中加入NaOH溶液,振荡静置,下层为无色油状液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100 mL 14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12 mol
C.得到5.08 g沉淀时,加入NaOH溶液的体积是700 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸钡与盐酸反应2H++BaCO3===Ba2++H2O+CO2↑
B. 氢氧化钡溶液与稀硫酸混合Ba2++![]() +H++OH-===BaSO4↓+H2O
+H++OH-===BaSO4↓+H2O
C. 金属钠与水的反应 Na+H2O===Na++OH-+H2↑
D. 铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出要对环境问题进行全面、系统的可持续治理。绿色能源是实施可持续发展的重要途径,利用生物乙醇来制取绿色能源氢气的部分反应过程如下图所示:

(1)已知:CO(g) +H2O(g)CO2(g)+H2(g) H1=-41 kJ·mol-1
CH3CH2OH(g)+3H2O(g)2CO2(g)+6H2(g) H2 =+174.1 kJ·mol-1
反应I的热化学方程式为______。
(2)反应II在进气比[n(CO) : n(H2O)]不同时,测得相应的 CO 平衡转化率见下图(各点对应的反应温度可能相同,也可能不同;各点对应的其他反应条件都相同)。

①图中A、E和 G三点对应的反应温度TA、TE、TG的关系是_____,其原因是 ______。该温度下,要提高CO平衡转化率,除了改变进气比之外,还可采取的措施是______。
②由图中可知CO的平衡转化率与进气比、反应温度之间的关系是____。
③A、B 两点对应的反应速率大小:vA_____vB(填“<” “=”或“>”)。已知反应速率 v=v正v逆= k正x(CO)x(H2O) k逆x(CO2) x(H2) ,k为反应速率常数,x为物质的量分数,在达到平衡状态为D点的反应过程中,当CO的转化率刚好达到20%时,![]() =_____。
=_____。
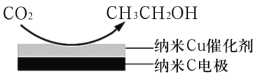
(3)反应III在饱和KHCO3电解液中,电解活化的CO2来制备乙醇,其原理如图所示,则阴极的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com