

| A、Na2CO3 |
| B、Cu2(OH)2CO3 |
| C、NaCl |
| D、NaHSO4 |
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:

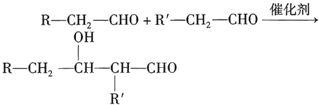
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、温度计的水银球应插入蒸馏烧瓶中的自来水中 |
| B、冷凝管中的水流方向是从下口进入,上口排出 |
| C、实验中需要在蒸馏烧瓶中加入几粒碎瓷片,防止出现暴沸现象 |
| D、蒸馏烧瓶必须垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:
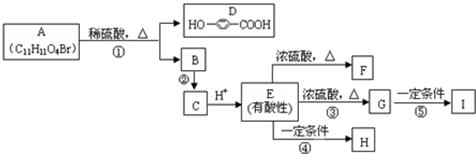
查看答案和解析>>
科目:高中化学 来源: 题型:
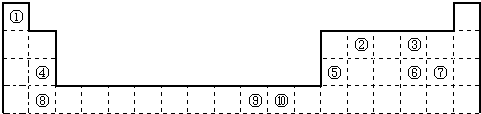
| 电离能I(eV) | A | B | C | D | E | F |
| I1 | 11.3 | 14.5 | 13.6 | 5.2 | 7.6 | 6.0 |
| I2 | 24.4 | 29.6 | 35.1 | 49.3 | 15.0 | 18.8 |
| I3 | 47.9 | 47.4 | 54.9 | 71.6 | 80.1 | 28.4 |
| I4 | 64.5 | 77.5 | 77.4 | 98.9 | 109.2 | 112.0 |
| I5 | 392.1 | 97.9 | 113.9 | 138.3 | 141.3 | 153.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,有5L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据填空
某温度时,有5L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据填空查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com