
 某温度时,有5L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据填空
某温度时,有5L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据填空| △c |
| △t |
| ||
| 2min |


科目:高中化学 来源: 题型:
| ||
| A、KClO3在反应中失去电子 |
| B、ClO2是氧化产物 |
| C、H2C2O4在反应中被还原 |
| D、此反应中每生成1 mol ClO2转移的电子为1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| B、将混有少量HCl的CO2通入饱和NaHCO3溶液中除去HCl |
| C、用湿润的pH试纸测定等浓度的Na2CO3和Na2SO3溶液的pH大小 |
| D、用AgNO3溶液鉴别Na2SO4溶液与NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
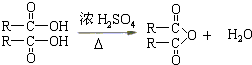
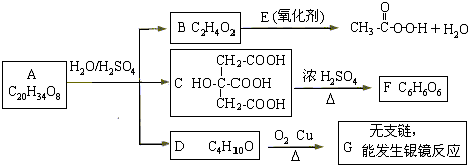
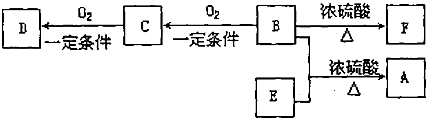
查看答案和解析>>
科目:高中化学 来源: 题型:
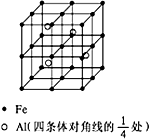 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
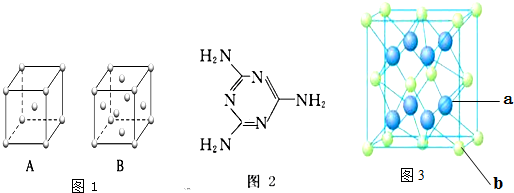
查看答案和解析>>
科目:高中化学 来源: 题型:
 结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:
结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com