
| n |
| V |


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
| A、0.1mol |
| B、0.5mol |
| C、0.15mol |
| D、0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
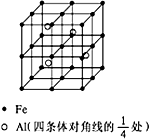 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
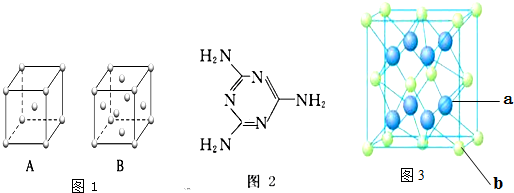
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 实验温度 | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
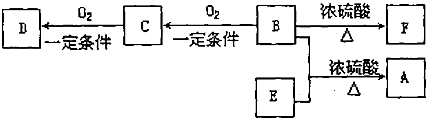
 结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:
结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:查看答案和解析>>
科目:高中化学 来源: 题型:
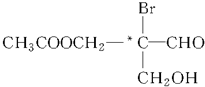 下列有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )
下列有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列反应,生成的有机物分子中含有手性碳原子的是( )| A、与乙酸发生酯化反应 |
| B、在稀硫酸作用下水解 |
| C、与银氨溶液作用发生银镜反应 |
| D、催化剂作用下与H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银氨溶液中加入足量盐酸产生沉淀[Ag(NH3)2]-+OH-+3H++Cl-═AgCl↓+2NH4++H2O |
| B、在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解3BaSO3+2H++2NO3-═3BaSO4↓+2NO↑+H2O |
| C、孔雀石可溶于盐酸 CO32-+2H+═CO2↑+H2O |
| D、氧化铁可溶于氢碘酸 Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com