
【题目】常温下,向1L0.1molL﹣1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( ) 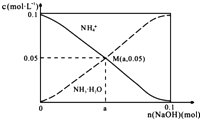
A.M点溶液中水的电离程度比原溶液大
B.在M点时,n(OH﹣)﹣n(H+)=(a﹣0.05)mol
C.随着NaOH的加入, ![]() 不断增大
不断增大
D.当n(NaOH)=0.05mol时溶液中有:c(Cl﹣)>c(Na+)>c(NH4+)>c(OH﹣)>c(H+)
【答案】B
【解析】解:A.M点是向1L 0.1molL﹣1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离,此时水的电离程度小于原氯化铵溶液中水的电离程度,故A错误;B.在M点时溶液中存在电荷守恒,n(0H﹣)+n(Cl﹣)=n(H+)+n(Na+)+n(NH4+),n(0H﹣)﹣n(H+)=0.05+n(Na+)﹣n(Cl﹣)=(a﹣0.05)mol,故B正确;
C.铵根离子水解显酸性,结合水解平衡常数分析 ![]() ×
× ![]() =
= ![]() ,随氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则
,随氢氧化钠固体加入,反应生成一水合氨浓度增大,平衡常数不变,则 ![]() 减小,故C错误;
减小,故C错误;
D.向1L 0.1molL﹣1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.05mol时,得到物质的量均为0.05molNH4Cl、0.05molNaCl和0.05molNH3H2O的混合物,由于NH3H2O电离大于NH4Cl水解,故离子浓度大小关系为:c(Cl﹣)>c(NH4+)>c(Na+)>c(OH﹣)>c(H+),故D错误.
故选B.
A.M点是向1L 0.1molL﹣1NH4Cl溶液中,不断加入NaOH固体后反应得到氯化铵和一水合氨溶液,铵根离子浓度和一水合氨浓度相同,一水合氨是一元弱碱抑制水电离;
B.依据溶液中电荷守恒分析判断,n(Na+)=amol,n(Cl﹣)=1mol;
C.铵根离子水解显酸性,结合水解平衡常数分析, ![]() ×
× ![]() =
= ![]() ;
;
D.向1L 0.1molL﹣1NH4Cl溶液中,不断加入NaOH固体后,当n(NaOH)=0.05mol时,得到物质的量均为0.05molNH4Cl、0.05molNaCl和0.05molNH3H2O的混合物.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2两种离子化合物。
(1)写出Y2O和Y2O2的电子式:_______________________、________________________,其中后者含有的化学键是______________(填“离子键”、“极性键”或“非极性键”);
(2)XH3、H2Z和HW三种化合物,沸点最高的是____________(填化学式);
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,酸性最强的是_________(填化学式);
(4)用电子式表示Y2O的形成过程______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,1 mol X2和 3mol Y2化合成 2mol 的化合物Z, 则化合物Z的化学式为 ( )
A. XY3B. XYC. X3YD. X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的K2SO4、NaCl、Ba(NO3)2、AgNO3混合均匀后,置于指定容器中,加入足量的水,搅拌、静置、过滤.取滤液,用铂电极电解一段时间.则两极区析出的氧化产物与还原产物的质量比约为( )
A.35.5:108
B.108:35.5
C.8:1
D.1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为预防和控制高血压,WHO建议每人每天食盐摄入量应少于 6g。下列叙述正确的是 ( )
A. 氯化钠溶液在电流作用下电离成Na+和Cl-
B. 某物质若不是电解质,就一定是非电解质
C. 硫酸钡难溶于水,但硫酸钡是电解质
D. 二氧化碳的水溶液能导电,故二氧化碳属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂.某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3 , 并探究NCl3的漂白性.NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为﹣40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |
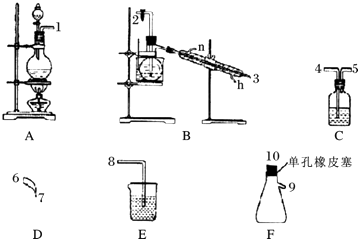
回答下列问题:
(1)根据实验目的,接口连接的顺序为1﹣﹣﹣2﹣3﹣6﹣7﹣﹣
(2)C装置中盛放的试剂为饱和食盐水,E装置中盛放的试剂为 .
(3)A装置中发生反应的离子方程式为 .
(4)B装置中发生反应的化学方程式为 , 当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为 .
(5)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50﹣60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,结合反应方程式解释该现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ①和④ D. ③和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍原子比铝原子少1个电子层,最外层电子数也比铝原子少1,在周期表中铍和铝的位置关系存在有“对角线”关系的元素性质存在相似性。下列关于铍的判断不正确的是( )
A. Be能在空气中燃烧 B. BeO熔点较低
C. BeCl2是共价化合物 D. Be(OH)2具有两性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com