
【题目】在一定条件下,1 mol X2和 3mol Y2化合成 2mol 的化合物Z, 则化合物Z的化学式为 ( )
A. XY3B. XYC. X3YD. X2Y3
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】下列溶液混合后,不会发生离子反应的是( )
A. 硝酸钡溶液和硫酸钠溶液B. 醋酸钠溶液和稀硫酸
C. 碳酸钾溶液和硫酸氢钠溶液D. 硝酸钾溶液和氯化铜溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有铁和铜的混合物17.5g,其中铁的质量分数为32%,与足量盐酸反应。
(1)参加反应的铁的物质的量是多少;__________
(2)生成标准状况下的氢气的体积__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的A12O3固体加入100mLNaOH溶液中,固体全部溶解,向所得溶液中逐滴加入1.0 molL-1盐酸,所得沉淀的物质的量与加入盐酸体积的关系如图所示(不考虑溶液体积的变化),则下列说法正确的是

A. 原NaOH溶液的浓度为1.0mol/L B. 原A12O3的质量为0.51g
C. V0的数值为35 D. 沉淀量达到最大时,溶液的溶质有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量高于生成物的总能量时,该反应常温下即可发生
B.氢气燃烧热为285.8kJmol﹣1 , 则有H2(g)+1/2O2(g)=H2O(g)△H=﹣285.8kJmol﹣1
C.将1molBa(OH)2的稀溶液与稀盐酸完全中和,放出114.6kJ的热量,热化学方程式为:OH﹣(aq)+H+(aq)=H2O(l)△H=﹣114.6kJmol﹣1
D.2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将2molSO2(g)和足量O2置于一密闭容器中,充分反应后放出的热量一定小于QkJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1molL﹣1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( ) 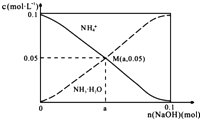
A.M点溶液中水的电离程度比原溶液大
B.在M点时,n(OH﹣)﹣n(H+)=(a﹣0.05)mol
C.随着NaOH的加入, ![]() 不断增大
不断增大
D.当n(NaOH)=0.05mol时溶液中有:c(Cl﹣)>c(Na+)>c(NH4+)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去括号内杂质所用试剂和方法都正确的是 ( )
A. Cu(Fe):加稀硫酸,蒸馏 B. CO2(SO2):氢氧化钠溶液,洗气
C. NaCl溶液(碘):酒精,萃取、分液 D. N2(O2):将气体缓缓通过灼热的铜网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
A.等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO ![]() )的大小关系为:②>④>③>①
)的大小关系为:②>④>③>①
B.pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH﹣)+c(HC2O ![]() )+c(C2O
)+c(C2O ![]() )
)
C.向0.2 mol?L﹣1NaHCO3 溶液中加入等体积0.1 mol?L﹣1NaOH 溶液:c(CO ![]() )>c(HCO3﹣)>c(OH﹣)>c(H+)
)>c(HCO3﹣)>c(OH﹣)>c(H+)
D.常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH﹣)>c(Na+)+c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com