
【题目】五种短周期元素的部分性质数据如下:
元素 | T | X | Y | Z | W |
原子半径(mm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
(1)Z离子的结构示意图为_______________。
(2)关于Y、Z两种元素,下列叙述正确的是__________(填序号)。
a 简单离子的半径Y>Z
b 气态氢化物的稳定性Y比Z强
c 最高价氧化物对应水化物的酸性Z比Y强
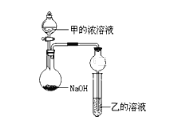
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物。某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是____________________________。一段时间后,观察到试管中的现象是_________________________,发生反应的离子方程式是___________________________。
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被氢氧化钠溶液吸收的化学方程式是: 2XO2+2NaOH=M+NaXO3+H2O (已配平),产物M中元素X的化合价为__________。
【答案】![]() b NH3+H2O
b NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小 有白色沉淀生成 Al3++3 NH3·H2O ==Al(OH)3↓+3 NH4+ +3
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小 有白色沉淀生成 Al3++3 NH3·H2O ==Al(OH)3↓+3 NH4+ +3
【解析】
五种短周期元素,Y有+7、-1价,则Y为Cl,Z有+6、-2价,则Z为S元素;X有+5、-3价,处于ⅤA族,原子半径小于Cl,故Y为N元素;W有最高正价+3,处于ⅢA族,原子半径大于Cl,故W为Al;T有最高正价+1,处于ⅠA族,原子半径小于N,故T为H元素,据此答题。
(1)由Z为短周期元素,其化合价为+6、-2,则Z为S元素,其质子数为16,S2-带2个单位的负电荷,则最外层电子数为8,故S2-的结构示意图为![]() ,故答案为:
,故答案为:![]() 。
。
(2)由Y的化合价及Y为短周期元素,则Y为Cl,氯离子半径小于硫离子半径,则a错误;氯比硫元素的非金属性强,则HCl的稳定性强于H2S,则b正确;氯比硫元素的非金属性强,则高氯酸的酸性大于硫酸的酸性,则c错误,故答案为:b。
(3)由表中的化合价及元素都在短周期,T、X两种元素形成的10e-分子,T为H元素,W为Al元素,则甲为氨气,乙为氯化铝,由图可知,烧瓶中发生氨水与氢氧化钠的反应制取氨气,试管中发生氯化铝与氨水的反应生成沉淀,制取氨气的原理为NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小,试管中的反应为Al3++3NH3H2O=Al(OH)3↓+3NH4+,故答案为:NH3+H2O
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小,试管中的反应为Al3++3NH3H2O=Al(OH)3↓+3NH4+,故答案为:NH3+H2O![]() NH3H2O
NH3H2O![]() NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小;有白色沉淀生成;Al3++3NH3H2O=Al(OH)3↓+3NH4+。
NH4++OH-,NaOH溶于水电离出OH-,使平衡向左移动,且溶解时放出热量,使NH3的溶解度减小;有白色沉淀生成;Al3++3NH3H2O=Al(OH)3↓+3NH4+。
(4)由X的化合价可知X为第ⅤA族元素,XO2是导致光化学烟雾的“罪魁祸首”之一,则X为N元素,再由2XO2+2NaOH=M+NaXO3+H2O可知,NO2中N元素的化合价+4价,NaNO3中N元素的化合价为+5价,由氧化还原反应中得失电子守恒可知M中N的化合价为+3价,故答案为:+3。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】已知溴单质的沸点为 59 ℃,微溶于水,有毒性和强腐蚀性。某学习小组在探究从工业溴中提溴单质的实验中使用如下装置:

(1)①实验室保存液溴的方法是:_____,图中仪器 B 的名称是:_____。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_____。
④C 中液体产物的颜色为_______,为除去该产物中仍残留的少量 Cl2,可向其中加入 NaBr 溶液,充 分反应后,再进行的分离操作是_______(填操作名称)。
⑤工业上常用 SO2 水溶液吸收 Br2,有关反应的离子方程式为__________。
(2)Br2 和 FeCl3 的稀溶液均呈黄色。将少量稀溴水滴入稀 FeCl2 溶液得黄色溶液,某同学设计实验验证二者混合能否发生反应:取少量混合溶液,加入淀粉碘化钾溶液,振荡溶液变蓝色,他认为二者未发生化学反应,该实验设计不正确,错误在于____________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为______molL-1.
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______.
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400molL-1的稀盐酸.
①该学生需要量取______mL上述浓盐酸进行配制.
②所需的实验仪器有:胶头滴管、烧杯、量筒、玻璃棒,配制稀盐酸时,还缺少的仪器有_________________________.
(4)①假设该同学成功配制了0.400molL-1的盐酸,他又用该盐酸中和含0.4gNaOH的NaOH溶液,则该同学需取______mL盐酸.
②假设该同学用新配制的盐酸中和含0.4gNaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是___________.
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝的叙述中,正确的是( )
A.铝是地壳中含量最多的金属元素B.铝在常温下不能与氧气反应
C.铝不能与强酸或强碱发生反应D.电解熔融的氯化铝可制得铝单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2![]() 2PbO+2SO2;
2PbO+2SO2;
③制粗铅:PbO+C![]() Pb+CO↑;PbO+CO
Pb+CO↑;PbO+CO![]() Pb+CO2。
Pb+CO2。
下列说法正确的是
A. 浮选法富集方铅矿的过程属于化学变化
B. 将1mol PbS冶炼成Pb理论上至少需要6g碳
C. 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
D. 整个冶炼过程中,制取1mol Pb共转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaN3(叠氮化钠)是一种易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂.实验室制取叠氮化钠的原理、实验装置及步骤如下:

实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气.
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热D并关闭旋塞.
③向装置A中b容器内充入加热介质并加热到210一220℃,然后通入N2O.
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩、结晶.
⑤过滤,用乙醚洗涤,晾干.
已知:NaNH2熔点210℃,沸点400℃,在水溶液中易水解.
回答下列问题:
(1)图中仪器a用不锈钢材质而不用玻璃,其主要原因是___.
(2)装置B中盛放的药品为___;装置C的主要作用是___.
(3)步骤①先加热通氨气的目的是___;步骤②氨气与熔化的钠反应的方程式为___.
(4)步骤③b容器充入的介质为植物油,进行油浴而不用水浴的主要原因是___.
(5)生成NaN3的化学方程式为___.
(6)步骤⑤用乙醚洗涤的主要目的是___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年诺贝尔物理学奖所指向的是碳的又一张奇妙脸孔:人类已知的最薄材料——石墨烯。下列说法中,正确的是 ( )

A. 固态时,碳的各种单质的晶体类型相同
B. 石墨烯含有极性键
C. 从石墨剥离得石墨烯需要破坏化学键
D. 石墨烯具有导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。真空碳热还原一氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g);△H= a kJmol-1
3AlCl(g)= 2Al(l)+ AlCl3(g);△H= b kJmol-1
反应Al2O3(s)+ 3C(s)= 2Al(l)+ 3CO(g)的△H=______ kJmol-1(用含a、b的代数式表示)。
(2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,试回答下列问题:
①若起始时c(CO)=2molL﹣1,c(H2O)=3molL﹣1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=__.
②在相同温度下,若起始时c(CO)=1molL﹣1,c(H2O)=2molL﹣1,反应进行一段时间后,测得H2的浓度为0.5molL﹣1,则此时该反应是否达到平衡状态__(填“是”与“否”),此时v(正)__v(逆)(填“大于”“小于”或“等于”),你判断的依据是____________________
③若降低温度,该反应的K值将__,该反应的化学反应速率将__(均填“增大”“减小”或“不变”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com