
【题目】下列关于铝的叙述中,正确的是( )
A.铝是地壳中含量最多的金属元素B.铝在常温下不能与氧气反应
C.铝不能与强酸或强碱发生反应D.电解熔融的氯化铝可制得铝单质
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】化学学习和研究离不开元素周期表。表为元素周期表的一部分,表中①-⑩分别代表一种元素。回答下列问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
3 | ⑧ | ⑨ | ⑩ |
(1)上述元素中,有一种元素在自然界中形成的物质种类最多,该元素在周期表中的位置是______。
(2)⑧、⑨、⑩元素的离子半径由大到小的顺序为______(用离子符号表示)。
(3)写出由①、⑥、⑧三种元素形成的一种离子化合物的电子式___________。
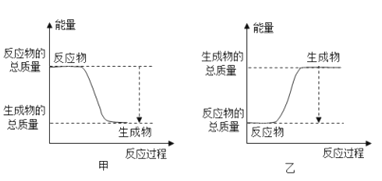
(4)上述元素中有一种元素的氧化物和氢氧化物都有两性,画出该元素的原子结构示意图______;高温条件下,该元素的单质与铁红能发生反应,此反应常用于野外焊接钢轨,则该反应的能量变化可用图______表示。![]() 填“甲“或“乙”
填“甲“或“乙”![]()
从①-⑩中任选元素,按下面要求写出一个置换反应:_____________________。要求:非金属单质1 + 化合物1→非金属单质2 + 化合物2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化钠与过氧化钠的说法正确的是( )
A.它们属于碱性氧化物
B.它们都能与水反应产生氧气
C.它们都能与二氧化碳发生氧化还原反应
D.过氧化钠是潜水艇和呼吸面具的供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2mol X和2mol Y充入2L密闭容器中进行反应:X(g)+3Y(g) ![]() 2Z(g)+aQ(g)。2min末该反应达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol·L-1,下列叙述错误的是( )
2Z(g)+aQ(g)。2min末该反应达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol·L-1,下列叙述错误的是( )
A. a的值为2
B. 平衡时X的浓度为0.8mol·L-1
C. 平衡时Y的转化率60%
D. 0~2min内Y的反应速率为0.6mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向体积为2L的密闭容器中通入NO2 (气体)和N2O4 (无色气体),二者之间可相互转化,反应过程中各物质的物质的量随时间的变化曲线如图所示。回答下列问题:

(1)0~3min内用N2O4表示的平均反应速率为___________。
(2)若升高温度,则v(正)__________(填“加快”“减慢”或“不变”,下同),v(逆)___________。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得:甲中v(NO2)=0.2mol·L-1·s-1,乙中v(N2O4)=9mol·L-1·min-1,则_________(填“甲”或“乙”)中反应更快。
(4)下列叙述能说明该反应已达到化学平衡状态的是(_____)
A v(NO2)=2 v(N2O4)
B 容器内压强不再发生变化
C X的体积分数不再发生变化
D 容器内气体的原子总数不再发生变化
E 相同时间内消耗n mol Y的同时生成2n mol X
F 相同时间内消耗n mol Y的同时消耗2n mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素的部分性质数据如下:
元素 | T | X | Y | Z | W |
原子半径(mm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
(1)Z离子的结构示意图为_______________。
(2)关于Y、Z两种元素,下列叙述正确的是__________(填序号)。
a 简单离子的半径Y>Z
b 气态氢化物的稳定性Y比Z强
c 最高价氧化物对应水化物的酸性Z比Y强
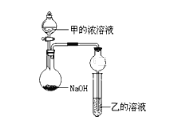
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物。某同学设计了如图所示装置(夹持仪器省略)进行实验,将甲的浓溶液逐滴加入到NaOH固体中,烧瓶中即有甲放出,原因是____________________________。一段时间后,观察到试管中的现象是_________________________,发生反应的离子方程式是___________________________。
(4)XO2是导致光化学烟雾的“罪魁祸首”之一。它被氢氧化钠溶液吸收的化学方程式是: 2XO2+2NaOH=M+NaXO3+H2O (已配平),产物M中元素X的化合价为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮化合物对能源、环保和生产具有重要的意义。请回答下列问题:
(1)在2 L密闭容器内, 800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①如图所示A点处v正___(填“>”、“<”或“=”,下同)v逆,A点处v正___B点处v正。
②如图所示的曲线,其中表示NO2的变化的曲线是________(填a、b、c、d等字母)。用O2表示2 s内该反应的速率v=________。
(2)已知化学反应N2+3H2![]() 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
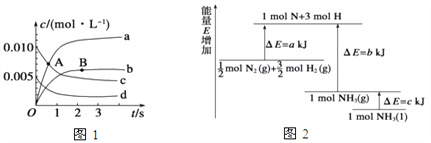
则,1 mol N和3 mol H生成1 mol NH3(g)是______能量的过程(填“吸收”或“释放”),由![]() mol N2(g)和
mol N2(g)和![]() mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
mol H2(g)生成1 mol NH3(g)过程________(填“吸收”或“释放”)_______kJ能量(用含字母a、b、c的关系式表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构为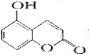 , ,下列有关说法正确的是
, ,下列有关说法正确的是
A.1 mol该物质与足量淮溴水反应,最多消耗2 molBr2
B.1mol该物质最多能与2mol NaOH反应
C.l mol该物质晟多能与3 mol H2加成
D.该物质的核磁共振氢谱共有6个吸收峰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com