
【题目】硫代硫酸钠是冲洗照相底片的定影剂,棉织物漂白后的脱氯剂。易溶于水,不溶于乙醇,受热、遇酸均反应。实验室模拟工业制备硫代硫酸钠晶体通常有以下方法,请回答有关问题。
方法一:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,主要实验装置如下:
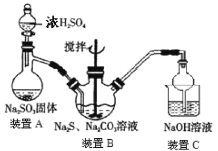
(1)装置A中不可用稀硫酸代替浓硫酸,理由是________。
(2)下列操作或描述正确的是________。
A. 为了提高硫代硫酸钠的产量,反应过程中需通入过量的SO2
B. 装置B中可能含有杂质Na2CO3、NaHCO3、Na2SO3、Na2SO4等其中的一种或几种
C. 粗产品可通过重结晶提纯,洗涤操作时应选择乙醇作洗涤剂
D. 装置C的作用是防倒吸
方法二:
Na2SO3+S+5H2O=Na2S2O3·5H2O,简易实验流程如下:
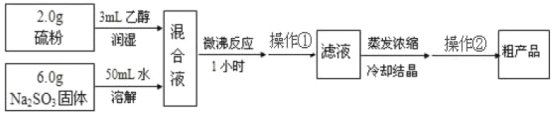
(3)操作①为趁热过滤,其目的是________。
(4)操作②是减压过滤,装置如下图所示,下列说法正确的是________。
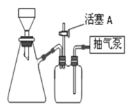
A. 滤纸应比漏斗内径略小,且能盖住所有小孔
B. 图抽滤装置中只有一处错误,即漏斗颈口斜面没有对着吸滤瓶的支管口
C. 抽滤完毕后,应先打开活塞A,再关水龙头,以防倒吸
D. 抽滤得到的滤液应从吸滤瓶的支管口倒出
(5)用I2的标准溶液测定产品的纯度
取10.00g产品,配制成100.0mL溶液。取10.00mL溶液。以淀粉溶液为指示剂,用浓度为0.1000mol/LI2的标准溶液进行滴定,相关数据记录如下表所示。

则Na2S2O3·5H2O在产品中的质量分数是________。
【答案】生成的二氧化硫在稀硫酸中溶解性比较大,不易逸出 BC 防止温度降低导致Na2S2O3晶体析出,从而降低Na2S2O3产率 AC 99.20%
【解析】
(1)生成的二氧化硫在稀硫酸中溶解性比较大,不易逸出,故装置A中不可用稀硫酸代替浓硫酸;
(2)A. 硫代硫酸钠在酸性条件下会发生水解,二氧化硫过量会使溶液呈酸性,导致产品产量减少,所以为了提高硫代硫酸钠的产量,反应过程中不能通入过量的SO2,选项A错误;
B. 装置B中二氧化硫与硫化钠、碳酸钠反应,可能含有杂质Na2CO3、NaHCO3、Na2SO3、Na2SO4等其中的一种或几种,选项B正确;
C. 粗产品可通过重结晶提纯除去碳酸钠等杂质,洗涤操作时应选择乙醇作洗涤剂,减少产品的损失,选项C正确;
D. 装置C的作用是吸收可能产生的二氧化硫、硫化氢等气体,防止污染空气,选项D错误;
答案选BC;
(3)操作①为趁热过滤,其目的是防止温度降低导致Na2S2O3晶体析出,从而降低Na2S2O3产率;
(4)根据抽滤操作的规范要求可知,A、在组装装置时滤纸应比漏斗内径略小,且能盖住所有小孔,选项A正确;
B、在图2抽滤装置中有两处错误,漏斗颈口斜面应对着吸滤瓶的支管口,同时安全瓶中导管不能太长,选项B错误;
C、抽滤完毕后,应先拆下连接抽气泵和吸滤瓶的橡皮管,再关水龙头,以防倒吸,选项C正确;
D、抽滤得到的滤液应从吸滤瓶的上口倒出,选项D错误;
答案选AC;
(5)淀粉溶液作指示剂,用度为0.100mol/LI2的标准溶液进行滴定溶液中的碘,滴定终点时溶液由无色变蓝色,且半分钟不褪色;
第二组实验数据相差较大,舍去,故消耗标准液的体积为![]() =20.00mL,2S2O32-~I2,则n(Na2S2O35H2O)=2n(I2),故产品纯度为:
=20.00mL,2S2O32-~I2,则n(Na2S2O35H2O)=2n(I2),故产品纯度为: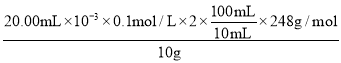 ×100%=99.20%。
×100%=99.20%。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】NH3是重要的化工原料。
(1)工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。工业上可用氨催化吸收法处理NOx,反应原理为:4x NH3 + 6NOx![]() (2 x + 3)N2 + 6x H2O
(2 x + 3)N2 + 6x H2O
某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
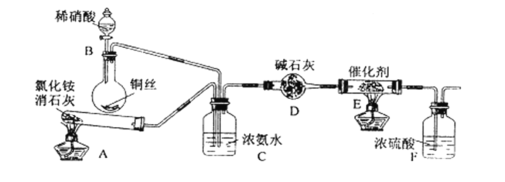
①装置A中发生反应的化学方程式为____________________。
②装置B中发生反应的化学方程式为____________________。
③装置D中碱石灰的作用是__________________________。
(2)按下图装置进行NH3性质实验。

①先打开旋塞1,B瓶中的现象是_________________________________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是_________________。
(3)下图是甲同学设计收集氨气的几种装置,其中可行的是________,集气的原理是________。
a. ![]() b.
b.  c.
c. 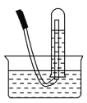 d.
d. 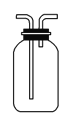
(4)为防止污染环境,以下装置(盛放的液体均为水)可用于吸收多余氨气的是________(填序号)。
①.  ②.
②.  ③.
③. 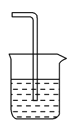 ④.
④. 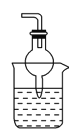
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.过量SO2通入次氯酸钠溶液中:SO2+ClO-+H2O=SO42-+Cl-+2H+
B.二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O
C.实验室制备Cl2:![]()
D.酸性介质中KMnO4氧化H2O2:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
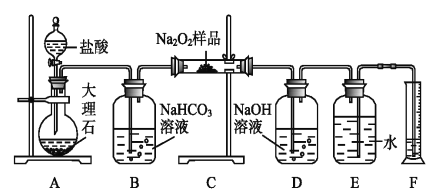
①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为______________________________;
(2)写出与H2O分子互为等电子体的微粒_________________________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是______________
A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
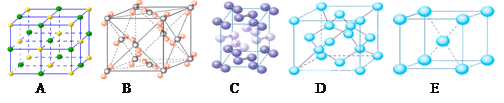
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_________(请用相应的编号填写)
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能” 是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出生成此配离子的离子方程式:__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰[(CN)2]、硫氰[(SCN)2]等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2===2Fe(SCN)3、Ag++CN-===AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2=2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (OCN)2+H2O =2H++OCN-+OCNO-
D. MnO2+4HSCN![]() (SCN)2+Mn(SCN)2+2H2O
(SCN)2+Mn(SCN)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应物的化学计量数与产物之间的关系是,使用类似数组的方法可以收到的直观形象的效果,下列表达不正确的是 ( )
A.分散质粒子直径与分散系种类:![]()
B.NaOH溶液与CO2反应后溶液中的钠盐:
C.Na与O2反应的产物:
D.A1C13溶液中滴加Na0H溶液后铝的存在形式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组比较Cl-、Br-、I- 的还原性,实验如下:
实验1 | 实验2 | 实验3 | |
装置 |
|
|
|
现象 | 溶液颜色无明显变化;把蘸浓氨水的玻璃棒靠近试管口,产生白烟 | 溶液变黄;把湿KI淀粉试纸靠近试管口,变蓝 | 溶液变深紫色;经检验溶液含单质碘 |
下列对实验的分析不合理的是
A. 实验1中,白烟是NH4Cl B. 根据实验1和实验2判断还原性:Br->Cl-
C. 根据实验3判断还原性:I->Br- D. 上述实验利用了浓H2SO4的强氧化性、难挥发性等性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com