
����Ŀ���ȣ�����Ԫ�ع㷺��������Ȼ���У����������������������Ҫ���塣
��1����������ɫ��______��![]() ��
��![]() ��ȼ�ջ�����ɫ��__________��
��ȼ�ջ�����ɫ��__________��
��2��Ũ������У������Ԣ�ǿ�����Ԣ���ˮ�Ԣ���ˮ�ԣ������������������ֳ�������Ϊ(����)
��������______��ʹ���DZ��________�����հ���_________����ͭ��Ӧ________��
��3��Ϊ�����ũ����IJ������¹���ѧ�ҹ�������ʩ�ȳɹ��ؿ����˽�����ת��Ϊ�������������ա����û�ѧ����ʽ��ʾ��ҵ�ϳɰ��ķ�Ӧԭ����________��ʵ������ȡ�����Ļ�ѧ����ʽ____________��
��4����Ȼ���γ�NO�Ļ�ѧ����ʽ��_____________���������![]() ����Ⱦ����������
����Ⱦ����������![]() ����Һ����
����Һ����![]() ������
������![]() ��9.2g
��9.2g![]() ��
��![]() ��ҹ��ȫ��Ӧʱת�Ƶ���0.1mol����Ӧ�����ӷ���ʽΪ_____________��
��ҹ��ȫ��Ӧʱת�Ƶ���0.1mol����Ӧ�����ӷ���ʽΪ_____________��
���𰸡�����ɫ ��ɫ �� �� �� �٢� N2+3H2![]() 2NH3 Ca(OH)2+2NH4Cl
2NH3 Ca(OH)2+2NH4Cl![]() CaCl2+2NH3��+2H2O N2+O2
CaCl2+2NH3��+2H2O N2+O2![]() 2NO 2NO2+CO32-=NO3-+NO2-+CO2
2NO 2NO2+CO32-=NO3-+NO2-+CO2
��������
(1)�����������������ʷ�����������һ�ֻ���ɫ�д̼�����ζ���ж����壬������������ȼ�շų���ɫ���棬�����Ȼ������壻
(2)Ũ����������Ժ�ǿ�����ԣ���Ԫ�ػ��ϼ�+6�۱仯Ϊ+4�ۣ�������ˮ�ԣ��������������е�ˮ������������ˮ�ԣ�����ʹ�л�������ԭ�Ӻ���ԭ����2��1��ȥ��ͭ��Ũ������ȷ�Ӧ��������ͭ�����������ˮ��
(3)��ҵ�ϳɰ���ԭ��Ϊ�����͵�����ʵ�������Ȼ�狀���ʯ�ҵĹ��������������ȡ������
(4)��Ȼ���γ�һ�����������ÿ����еĵ����������ŵ練Ӧ���ɣ���ÿ2mol
NO2��Na2CO3��Һ��Ӧʱת�Ƶ���1mol�������ɵ����ᣬ���ݻ��ϼ۵ı仯�ж�������Դ���д��Ӧ�����ӷ���ʽ��
(1)������һ�ֻ���ɫ���壬H2��Cl2��ȼ�շ�Ӧ�����Ȼ������壬H2+Cl2 ![]() 2HCl��ȼ�չ����з�����ɫ���棻
2HCl��ȼ�չ����з�����ɫ���棻
(2)Ũ������У������� ��ǿ������ ����ˮ�Ԣ���ˮ�ԣ������������������ֳ�������Ϊ����������������Ũ����Ģ���ˮ�ԣ�ʹ������������Ũ����Ģ���ˮ�ԣ������Ǽ������壬Ũ�������հ������õ���Ũ����Ģ����ԣ���ͭ��Ӧ��������ͭ�����������ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cu+2H2SO4(Ũ)![]() CuSO4+SO2��+2H2O���ڸ÷�Ӧ��Ũ���������˵Ģ����� ��ǿ�����ԣ�
CuSO4+SO2��+2H2O���ڸ÷�Ӧ��Ũ���������˵Ģ����� ��ǿ�����ԣ�
(3)��ҵ�ϳɰ���ԭ��Ϊ�����͵�����������ӦΪ��N2+3H2![]() 2NH3��ʵ�����������Ȼ�狀���ʯ�ҵĹ��������������ȡ��������ӦΪ��Ca(OH)2+2NH4Cl
2NH3��ʵ�����������Ȼ�狀���ʯ�ҵĹ��������������ȡ��������ӦΪ��Ca(OH)2+2NH4Cl![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
(4)��Ȼ���е����������ڷŵ������·�Ӧ����һ���������壬��Ӧ�Ļ�ѧ����ʽΪ��N2+O2![]() 2NO��9.2gNO2�����ʵ���Ϊn(NO2)=9.2g��46g/mol=0.2mol��ÿ2molNO2��Na2CO3��Һ��Ӧʱת�Ƶ���1mol����N�Ļ��ϼ۷ֱ���+4�۱仯Ϊ+5�ۺ�+3�ۣ��ڼ�����Һ��Ӧ����NO3-��NO2-����Ӧ�����ӷ���ʽΪ��2NO2+CO32-=NO3-+NO2-+CO2��
2NO��9.2gNO2�����ʵ���Ϊn(NO2)=9.2g��46g/mol=0.2mol��ÿ2molNO2��Na2CO3��Һ��Ӧʱת�Ƶ���1mol����N�Ļ��ϼ۷ֱ���+4�۱仯Ϊ+5�ۺ�+3�ۣ��ڼ�����Һ��Ӧ����NO3-��NO2-����Ӧ�����ӷ���ʽΪ��2NO2+CO32-=NO3-+NO2-+CO2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����£�0.01mol/L CH3COOH��Һ��c(H��)��4.32��10��4mol/L�����CH3COOH��Һ��ˮ�����ӻ�����Ϊ�� ��
A.<1��10��14B.>1��10��14C.��1��10��14D.��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����200 mL 2 mol��L��1 HNO3��Һ�У������������������������ɵ�����ֻ��һ�֣����ڴ˹����У�n(Fe2+)��n(Fe)�仯����ͼ��ʾ�������й�˵����ȷ����

A���ù����в�����״���µ�����4.48 L
B����c�㴦�ķ�ӦҺ�м���ϡ���������������
C��ͼ��a=1.5��b =1.5
D������������n molʱ(0.1��n��0.15)����Һ��n(Fe3+)=(0.3-2n)mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г��ӷ���������ǣ� ��
ѡ�� | ���ᴿ������ | ���� | �����Լ� | ���ӷ��� |
A |
|
| ���� | ϴ�� |
B |
|
| NaOH��Һ | ���� |
C |
| HCl(g) | ����ʳ��ˮ��Ũ | ϴ�� |
D |
|
| �� | ���� |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��ʾ�����ӵ�������ֵ������������ȷ���ǣ� ��
��ʾ�����ӵ�������ֵ������������ȷ���ǣ� ��
A. �ڱ�״���£�22.4L SO3���еĵ�����Ϊ40 NA
B. ����MnO2��400mL10mol/L�������ʱ��Ӧ��ת�Ƶĵ�����Ϊ2NA
C. ��50ml18mol/L��H2SO4��Һ�м���������ͭƬ���ȳ�ַ�Ӧ��.����ԭ��H2SO4������С��0.45NA
D. ��100ml12mol/L��HNO3��Һ�м���������ͭƬ��ַ�Ӧ�����ɵ�NO2�ķ���������0.6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ����������ķ�Ӧ������һֱ̽�ֺ��о�����Ҫ����֮һ��
��.ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣��Һ�ɫ����ΪCu2S������Cu2S�ķ�ӦΪaCu+bH2SO4![]() cCu2S+dCuSO4+eH2O����a��b=______.
cCu2S+dCuSO4+eH2O����a��b=______.
��.Ϊ�о����ʲ�������Ũ����ķ�Ӧ��ijѧϰС����̼�ظ�(������̼�ĺϽ�)����������̽�����
��̽��һ��(1)�����£���ҵ������������ʢ�����Ũ���ᣬ��ԭ����________��
(2)����Ũ�����ڼ���ʱ�Ļ�ѧ����ʽΪ��______________��
(3)��ȡ̼�ظ�6.0g����15.0mlŨ�����У����ȣ���ַ�Ӧ��õ���ҺX���ռ����������Y��
�ټ�ͬѧ��ΪX�г�Fe3+֮����ܺ���Fe2+����Ҫȷ�����е�Fe2+��Ӧѡ��____________��
a��KSCN��Һ����ˮ b�����ۺ�KSCN��Һ c��Ũ��ˮ d������KMnO4��Һ
����ͬѧȡ560mL(��״��������Yͨ��������ˮ�У�������Ӧ���������BaCl2��Һ�����ʵ�������ø������4.66g���ɴ���֪����Y��SO2���������Ϊ_______��
��̽��������������ʵ����SO2��������ķ�������ͬѧ��Ϊ����Y�л����ܺ���Q1��Q2�������壬����Q1�����ڱ�״�����ܶ�Ϊ0.0893g/L��Ϊ�����������̽��ʵ��װ��(ͼ�мг�����ʡ�ԣ������й�������ȫ��Ӧ)��
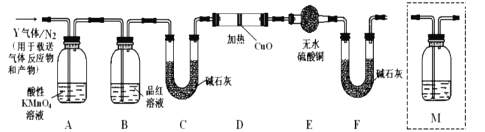
(4)װ��B���Լ���������__________��
(5)����Y�����е�![]() ������������ɵ�___________(�û�ѧ����ʽ��ʾ)��
������������ɵ�___________(�û�ѧ����ʽ��ʾ)��
(6)Ϊȷ��![]() �Ĵ��ڣ�����װ��������ϴ��ƿM��___________��
�Ĵ��ڣ�����װ��������ϴ��ƿM��___________��
a��A֮ǰ b��A-B�� c��B-C�� d��C-D��
��7���������Y�к���![]() ��Ԥ��ʵ������Ӧ��_________________��
��Ԥ��ʵ������Ӧ��_________________��
��.��һ��������Zn��100mLһ��Ũ�ȵ�H2SO4��ַ�Ӧ��
(1)����Ӧǰc(H2SO4)=12.0mol/L����Ӧ�����ʣ��п��������������65.0g������Ӧ�����Һϡ����1L����ʱ��Һ��c(SO42-)=______mo/L������SO2���(��״����)V(SO2)=______L��
(2)��(1)�в��������建��ͨ��100mL a mo/L NaOH��Һ�У�SO2��NaOH����ȫ���ģ���a��ȡֵ��ΧΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����dz������û�ѧ��Ӧ�е������仯Ϊ�������
(1)������һ�־��з�չǰ�������������Դ������ȼ��ʱ�ų��������ȡ�����ȼ������ˮ�����������仯����ͼ��ʾ��

������ͼ��֪��1molH2��ȫȼ������1molH2O(��̬)ʱ���ͷŵ�������___________kJ��
(2)���л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���___________��
A��Fe+2FeCl3=3FeCl2B��SO3+H2O=H2SO4
C��CH4+2O2![]() CO2+2H2O D��Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D��Ba(OH)2+H2SO4=BaSO4+2H2O
(3)��ͼ��ij��ȤС����Ƶ�ԭ���ʾ��ͼ��ʵ���������ʵ�鱨���ϼ�¼��Ϣ���£�

a��������ָ��ƫת |
b��Cu����H2���� |
c�� H+���ƶ� |
d��������Zn����������Cu |
��ʵ�鱨���м�¼��������___________(�����)��
����д���õ�صĸ�����Ӧʽ___________��
������1mol�����������ߣ��������ϲ���H2������Ϊ___________g��
�ܽ�ϡH2SO4����CuSO4��Һ�缫�������ӵ���___________(�п������ͭ������ ��ͬ)�� ��Һ��SO42-����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������A��B��C������ͼ��ʾ��ת����ϵ������H����H1+��H2����A��C������( )

��Fe��FeCl3 ��C��CO2 ��AlCl3��NaAlO2 ��NaOH��NaHCO3 ��S��CuS ��Na2CO3��CO2
A���ڢۢܢ� B���ڢۢܢݢ� C���٢ڢۢܢ� D���٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�Լ���ʵ�����еı��淽����ȷ����
A.�ƿɷ�ú���б���B.���ò���ϸ���Լ�ƿ���������
C.����ɫ���Լ�ƿ������ˮD.��ĥ�ڲ��������Լ�ƿ��������������Һ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com