
��Ⱦ�뻷�������Ѿ���Ϊ�����ҹ������ŵ�һ�����⣬��Ⱦ��Ϊ������Ⱦ��ˮ��Ⱦ��������Ⱦ�ȡ�
��1��Ϊ�˼��ٿ�����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϡ�
��֪��H2(g)�� O2(g)===H2O(g) ��H1����241.8 kJ��mol��1
O2(g)===H2O(g) ��H1����241.8 kJ��mol��1
C(s)�� O2(g)===CO(g) ��H2����110.5 kJ��mol��1
O2(g)===CO(g) ��H2����110.5 kJ��mol��1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ�� �� ��
�÷�Ӧ��ƽ�ⳣ������ʽΪK�� �� ��
��ϴ�Ӻ�SO2���������������ʿ���ϴ�Ӽ����� �� ��ѡ����ţ���
a��Ca(OH)2 b��CaCl2 c��Na2CO3 d��NaHSO3
��2��Ϊ�˼��ٿ����е�CO2��Ŀǰ��̼�����ڽ������������ŷ��о�����Ҫ�����ã���̼������(NH4)2CO3����ӦΪ��(NH4)2CO3(aq)��H2O(l)��CO2(g)��2NH4HCO3(aq) ��H3
 Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��ij�¶�
Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��ij�¶�
T1�£���һ������(NH4)2CO3��Һ�����ܱ������У�����
��һ������CO2���壨�õ�����Ϊϡ�ͼ�������tʱ�̣�
���������CO2�����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��
|
������ͬʱ����CO2����Ũ�ȣ����ϵ��ͼ7����
�٦�H3 �� 0(�����������������)��
����T4��T5����¶����䣬������CO2����Ũ�ȱ仯���Ƶ�ԭ���ǣ� �� ��



 ��3�������������͵绯ѧ���ⷨ����������ˮ�������ε���Ⱦ��
��3�������������͵绯ѧ���ⷨ����������ˮ�������ε���Ⱦ��
 �ٴ����������У���H2��NO
�ٴ����������У���H2��NO ��ԭΪN2��һ��ʱ���
��ԭΪN2��һ��ʱ���
��Һ�ļ���������ǿ����Ӧ���ӷ���ʽΪ�� �� ��
|
 ��ԭ����ͼ8����Դ����Ϊ�� ��
��ԭ����ͼ8����Դ����Ϊ�� �� ��ѡ���A����B������������ӦʽΪ�� �� ��
 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й����ʽṹ��˵����ȷ����
A��78 g Na2O2�������������������Ӹ�����Ϊ4NA
B��3.4 g�������0.6NA��N��H��
C��Na2O2�ĵ���ʽΪ: Na  Na
Na
D��PCl3��BCl3����������ԭ�ӵ�����㶼�ﵽ8�����ȶ��ṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Ԫ��X��Y��Z��W ��ԭ��������������Xԭ�ӵ��������������ڲ��������2����X��Zͬ���壬Y����Ԫ��ͬ���壬Wԭ�ӵ������������ȴ�����������1������˵����ȷ����
A��Ԫ��X�γɵĵ���һ����ԭ�Ӿ���
B��ԭ�Ӱ뾶�Ĵ�С˳��r(W)>r(Z)>r(Y) >r (X)
C��Y����Ԫ���γɵĻ�����Y2O2�����������ӵĸ�����Ϊ1:2
D��W�ֱ���Y��Z�γɵĻ������к��еĻ�ѧ��������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ��ȷ����
A��HCO3��ˮ������ӷ���ʽ��HCO3����H2O CO32����H3O��
CO32����H3O��
B��Ư����Һ�ڿ�����ʧЧ��ClO����CO2��H2O��HClO��HCO3��
C��������SO2ͨ��NaOH��Һ�У�SO2��+2OH����SO32��+H2O
|

| |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶�ʱ�����ݻ�Ϊ2L���ܱ������г���һ������SO2��O2��������Ӧ
2SO2(g)+O2(g) 2SO3(g) ∆H��−196kJ��moL−1��һ��ʱ����ƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
2SO3(g) ∆H��−196kJ��moL−1��һ��ʱ����ƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
| ��Ӧʱ��/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
����˵������ȷ����
A����Ӧ��ǰ5min��ƽ������Ϊv (SO2)=0.08mol��L−1 min−1
B�������¶Ȳ��䣬��ƽ�����������ٳ���1molSO2��0.5molO2ʱ��v (��)�� v (��)
C�����������������䣬����ʼʱ�������г���2molSO3����ƽ��ʱ����78.4kJ������
D����ͬ�¶��£���ʼʱ�������г���1.5mol SO3����ƽ��ʱSO3��ת����Ϊ40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͼ��ʾװ����ȡ�����е����ָ������������(��Ҫʱ���Լ��ȣ�a��b��c��d��ʾ��Ӧ�����м�����Լ�)��������ȷ���� (����)��
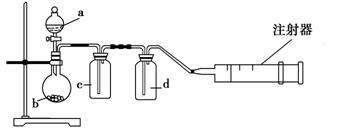
| ѡ | ���� | a | b | c | d |
| A | SO2 | Ũ���� | Cu | H2O | Ũ���� |
| B | Cl2 | Ũ���� | MnO2 | NaOH��Һ | Ũ���� |
| C | NH3 | ����NH4Cl�� | ��ʯ�� | �ռ���ƿ | ����NaOH |
| D | NO | ϡ���� | ͭм | H2O | Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и����е����ִ�������ԭ��������������������ʾ��Ԫ����������Ԫ�����ڱ��е�λ���������
| ||||||||||||||||||||||||||||||||||||
|
|
| ||||||||||||||||||||||||||||||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ�������ǽ��������ģ�����˵����ȷ����(����)
A��Ϊ��ֹ�����±��ȸ�֬ʳƷ�������ʣ����ڰ�װ���з�����ʯ��
B����ˮ�����ܽ����ˮ��ӦΣ������ˮ�мӾ�ˮ����������ʹ��ˮ����
C�������ڳ�ʪ�Ŀ����������⣬�为����ӦʽΪ2H2O��O2��4e��===4OH��
D���������ȼ����Ҫ��ѹ����Ȼ����Һ��ʯ�������࣬���Ǿ�����̼�⻯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
I����һ�ݻ�������ܱ������г���һ����A��B���������·�Ӧ��
xA(g) + 2B(s) yC(g) ��H< 0����һ�������£�������A��C�����ʵ���Ũ����ʱ��仯����������ͼ����ش��������⣺
yC(g) ��H< 0����һ�������£�������A��C�����ʵ���Ũ����ʱ��仯����������ͼ����ش��������⣺

��1����A��Ũ�ȱ仯��ʾ�÷�Ӧ0~10 min�ڵ�ƽ����Ӧ����V(A)=_______��
��2���Ʋ��10 min�������߱仯�ķ�Ӧ����������_____������ţ���ͬ������16 min�������߱仯�ķ�Ӧ����������______��
�ټ�ѹ ������A��Ũ�� ������C����
������ �ݽ��� �������
��3����ƽ��I��ƽ�ⳣ��ΪK1��ƽ��II��ƽ�ⳣ��ΪK2����K1______K2���>������=����<������
II. ��Ԫ������Ҫ�Ľ���Ԫ�أ��������ڹ�ҵ��������ʹ�õ���Ϊ��
���������кܶ�Ļ����P�仯ѧ��Ӧ��������ˮ�ķ�Ӧ��
3Fe(s) + 4H2O(g) Fe3O4(s) + 4H2(g) ��H
Fe3O4(s) + 4H2(g) ��H
��1����֪���� 3Fe(s) + 2O2(g) Fe3O4(s) ��H1=��1118.4 kJ/mol
Fe3O4(s) ��H1=��1118.4 kJ/mol
�� 2H2(g) + O2(g) 2H2O(g) ��H2=��483.8 kJ/mol
2H2O(g) ��H2=��483.8 kJ/mol
�� 2H2(g) + O2(g) 2H2O(l) ��H3=��571.8 kJ/mol
2H2O(l) ��H3=��571.8 kJ/mol
���H =____________________������������һλС������
��2����t ��ʱ���÷�Ӧ��ƽ�ⳣ��K=16����2 L���º����ܱ����������У��ֱ��±���ʾ�������ʣ���t ��ʱ��Ӧ����һ��ʱ���ﵽƽ�⡣
| Fe | H2O(g) | Fe3O4 | H2 | |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
�ټ�������H2O��ƽ��ת����Ϊ____________���������һλС����
������˵����ȷ����______________������ĸ��ţ�
A. ������ѹǿ�㶨����Ӧ�ﵽƽ��״̬
B. ���������ܶȺ㶨����Ӧ�ﵽƽ��״̬
C. ��������H2O��ƽ��ת���ʴ�����������H2O��ƽ��ת����
D. ����Fe3O4�������H2O��ת����
��3��������3����װ�ø�Ϊ���ݾ��ȣ�������罻����������װ�ã����±�
������ʼ���ʣ���ʼʱ��ƽ���ĸ����ʵ������±���
| Fe | H2O(g) | Fe3O4 | H2 | |
| ��ʼ/mol | 3.0 | 4.0 | 0 | 0 |
| ƽ��/mol | m | n | p | q |
���ڴ�ƽ����װ���м�������A��B��C����״���µĸ����ʣ����±���
|
| Fe | H2O(g) | Fe3O4 | H2 |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
���������淴Ӧ��һ�δﵽƽ��״̬��������װ����H2�İٷֺ������ɴ�С��˳�����У�___________________����A��B��C��ʾ����
��4��һ���Լ״���ȼ�ϵĵ��ʾ��ͼ����ͼ��д���õ�طŵ�ʱ�����ĵ缫��Ӧʽ��_______________________________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com