
【题目】ClO2是一种强氧化性气体(高浓度时呈红黄色,低浓度时呈黄色),在消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过下图所示装置(夹持装置略)对其进行制备、收集、吸收并制取NaClO2。
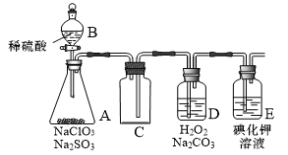
(1)仪器A的名称是______。
(2)图中装置有一明显错误,请指出:______。
(3)打开B的活塞,A中有ClO2生成,D中吸收ClO2后生成NaClO2和NaHCO3,写出D中所发生反应的离子方程式:______。
(4)E中溶液出现黄色能否说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,判断并说明理由:______。
(5)写出一种提高ClO2吸收率的方法:______。
(6)E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO2—,当pH≤2.0时,ClO2—能被I—还原。请补充完整检验E装置溶液中存在少量ClO2—的实验方案:取一定体积E装置中的溶液于分液漏斗中,______,则溶液中存在ClO2—。(实验中须使用的试剂有:CCl4、稀硫酸、淀粉溶液)
【答案】锥形瓶C装置中导气管应该长进短出2ClO2 +H2O2 +2CO32—=2ClO2—+O2↑+2HCO3—不能,因为 D 装置中有氧气产生,氧气也可能将 I 氧化为 I 2减缓稀硫酸的滴加速率(或 D 中长导管口加装多孔球泡等,合理即可)用 CCl 4 多次萃取、分液,直至溶液中滴加淀粉溶液不显蓝色。向溶液中滴加稀硫酸至溶液的 pH≤2,滴加淀粉溶液,溶液变蓝
【解析】
(1)根据仪器特征可知,仪器D的名称为锥形瓶,
因此,本题正确答案为:锥形瓶;
(2)C为ClO2气体收集装置,ClO2气体密度比空气大,C装置中导气管应该长进短出,
因此,本题正确答案为:C装置中导气管应该长进短出;
(3)D中溶液含有H2O2和Na2CO3吸收ClO2后生成NaClO2和NaHCO3,则发生氧化还原反应,ClO2作氧化剂将H2O2氧化为O2,所发生反应的离子方程式:2ClO2 +H2O2 +2CO32—=2ClO2—+O2↑+2HCO3—,
因此,本题正确答案为:2ClO2 +H2O2 +2CO32—=2ClO2—+O2↑+2HCO3—;
(4)E中溶液出现黄色可能生成了I2,由于D中生成了O2,也可能将 I 氧化为 I 2,所以不能说明ClO2未被H2O2和Na2CO3的混合溶液充分吸收,
因此,本题正确答案为:不能,因为 D 装置中有氧气产生,氧气也可能将 I 氧化为 I 2;
(5)要提高ClO2吸收率可以增加吸收时间或增大接触面积,故可采用减缓稀硫酸的滴加速率(或 D 中长导管口加装多孔球泡等),
因此,本题正确答案为:减缓稀硫酸的滴加速率(或 D 中长导管口加装多孔球泡等);
(6)根据题给信息及所提供的试剂,E装置吸收逸出的少量ClO2气体后所得溶液(pH为5.5~6.5)中存在少量ClO2-,同时生成I 2,用CCl4通过多次萃取可分离出I 2,加稀硫酸调溶液pH≤2.0时,ClO2—能被I-还原生成I 2,通过淀粉溶液检验生成的I 2,即可证明溶液中存在少量ClO2—,
因此,本题正确答案为:用 CCl 4 多次萃取、分液,直至溶液中滴加淀粉溶液不显蓝色。向溶液中滴加稀硫酸至溶液的 pH≤2,滴加淀粉溶液,溶液变蓝。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组混合液:①汽油和水;②75%的酒精溶液;③碘的水溶液,分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 分液、蒸馏、萃取
C. 萃取、蒸馏、分液 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,进行的可逆反应为A(固) +3B(气)![]() 3C(气)。下列叙述中表明可逆反应一定达到平衡状态的是( )
3C(气)。下列叙述中表明可逆反应一定达到平衡状态的是( )
①C的生成与分解速率相等 ②单位时间内生成amolA和3amolB
③B的浓度不再变化 ④混合气体总的物质的量不再发生变化
⑤A、B、C的物质的量之比为1:3:3 ⑥混合气体的密度不再变化
A. ①②③B. ①③④⑥C. ①③⑥D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家成功合成了新型抗肿瘤铂(Ⅳ)类化合物Pt( HPxSC)Cl3,请回答下列问题:
(1)基态磷原子价电子排布图为__________________。
(2)在元素周期表中,铂元素与铁元素同族,则铂元素位于_________。
A.s区 B.p区 C.d区 D. ds区 E.f区
(3)磷、硫、氯的第一电离能由小到大的顺序为__________________(填化学式)。
(4)与S同族的相邻元素氢化物沸点最高的为_________(填化学式),其原因为_________ 。
(5)铂(Pt)单质晶体中原子的堆积方式如图所示,由图可知,晶体铂的堆积方式为_________,一个晶胞中含有_________个铂原子,距离每个铂原子最近且等距离的铂原子有_________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,下列说法正确的是
2AB3(g) ΔH<0,下列说法正确的是
A. 升高温度,正、逆反应速率都加快,且正反应速率加快更明显
B. 升高温度能缩短达到平衡所需的时间且提高A2的转化率
C. 达到平衡后,同时升高温度和增大压强,n(AB3)有可能不变
D. 达到平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com