
A、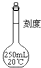 |
B、 |
C、 |
D、 |


科目:高中化学 来源: 题型:
 已知元素X、Y、Z质子数都小于18,并且质子数X+Y=Z.X原子的电子层数与核外电子总数相同,Z原子有两个电子层,最外层电子数是内层电子数的三倍,则:
已知元素X、Y、Z质子数都小于18,并且质子数X+Y=Z.X原子的电子层数与核外电子总数相同,Z原子有两个电子层,最外层电子数是内层电子数的三倍,则:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸存放在带橡皮塞的棕色玻璃瓶中 |
| B、汽油或煤油存放在带橡皮塞的棕色玻璃瓶中 |
| C、碳酸钠溶液存放在配有磨口塞的棕色玻璃瓶中 |
| D、氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104s1,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
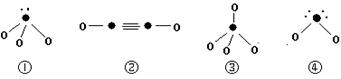
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
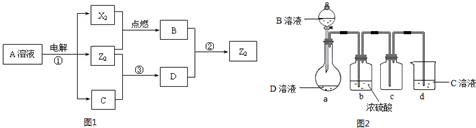
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com