
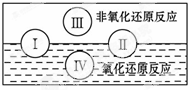
 已知元素X、Y、Z质子数都小于18,并且质子数X+Y=Z.X原子的电子层数与核外电子总数相同,Z原子有两个电子层,最外层电子数是内层电子数的三倍,则:
已知元素X、Y、Z质子数都小于18,并且质子数X+Y=Z.X原子的电子层数与核外电子总数相同,Z原子有两个电子层,最外层电子数是内层电子数的三倍,则: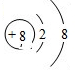 ,故答案为:H;N;
,故答案为:H;N;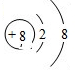 ;
;| 7 |
| 14 |
| 20 |
| 16 |
| ||
| ||


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| HCl |
| 实 验 序 号 | 初始浓度c/mol?L-1 | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.0010 | 290 |
| ② | 1.60 | 0.20 | 0.0010 | 145 |
| ③ | 0.80 | 0.40 | 0.0010 | 145 |
| ④ | 0.80 | 0.20 | 0.0020 | 580 |
| A、增大c(Br2),v(Br2)增大 |
| B、实验②和③的v(Br2)相 |
| C、增c(HCl),v(Br2)增大 |
| D、增大c(CH3COCH3),v(Br2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ABCDE |
| B、CDABE |
| C、BADCE |
| D、ECDBA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.第二周期ⅤA族 |
| B、.第三周期ⅣA族 |
| C、.第二周期ⅥA族 |
| D、.第三周期Ⅶ族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的HX酸与pH=11的YOH碱等体积混合,所得溶液的pH一定为7 |
| B、在0.1 mol/L (NH4)2Fe(SO4)2溶液中c(H+)+c(NH4+)+c(Fe2+)=c(OH-)+c(SO42-) |
| C、在醋酸钠溶液中加入适量醋酸,所得酸性溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、0.2 mol/L HCl与0.1 mol/L NaAlO2等体积混合,所得溶液中c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He的最外层电子数为2,所以42He具有较强的金属性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com