
【题目】按要求表示下列有机物:
(1)按系统命名法命名有机物![]() 的名称是 _________。
的名称是 _________。
(2) 4,4,5-三甲基-2-己炔(写出结构简式)_________________
(3) 对硝基苯乙烯(写出机构简式)__________________
(4) 2,2-二甲基-3-乙基-4-异丙基壬烷(写出结构简式)___________
【答案】2,3-二甲基戊烷 CH3C≡CC(CH3)2CH(CH3)2 ![]()
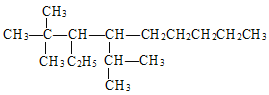
【解析】
(1)按系统命名法命名有机物![]() 的主链有5个碳原子,在2号和3号碳上分别连有一个甲基,所以名称是2,3-二甲基戊烷;答案:2,3-二甲基戊烷;
的主链有5个碳原子,在2号和3号碳上分别连有一个甲基,所以名称是2,3-二甲基戊烷;答案:2,3-二甲基戊烷;
(2)4,4,5-三甲基-2-己炔,主链有6个碳原子,2号碳与3号碳形成碳碳三键,4号碳上有2个甲基,5号碳上有1个甲基,结构简式为:CH3C![]() CC(CH3)2CH(CH3)2,故答案为:CH3C
CC(CH3)2CH(CH3)2,故答案为:CH3C![]() CC(CH3)2CH(CH3)2;
CC(CH3)2CH(CH3)2;
(3)对硝基苯乙烯的结构简式:![]() ,答案:
,答案:![]() ;
;
(4)2,2-二甲基-3-乙基-4-异丙基壬烷主链有9个碳原子,2号碳原子上有2个甲基,3号碳原子上有1个乙基,4号碳原子上有1个异丙基,结构简式为: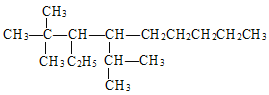 ;故答案为:
;故答案为: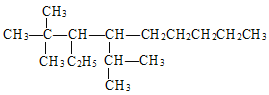 。
。


科目:高中化学 来源: 题型:
【题目】海水中蕴藏着丰富的资源。海水综合利用的流程图如下。
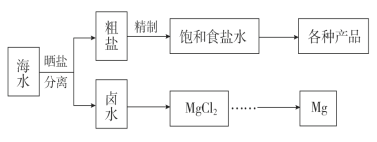
(1)用NaCl作原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是______。
②写出产物氯气制备“84”消毒液的离子方程式:______。
③NaCl也是侯氏制碱法的重要反应物之一,写出侯氏制碱法过程中涉及到的两个主要方程式:__________ , __________。
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O―→NaBr+NaBrO3+NaHCO3,吸收1 mol Br2时,转移的电子数为________mol。
(3)海水提镁的一段工艺流程如下图:
卤水![]()
![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2![]() Mg
Mg
①采用石墨电极电解熔融的氯化镁,发生反应的化学方程式_________;
②电解时,若有少量水存在,则不能得到镁单质,写出有关反应的化学方程式__________。
(4)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
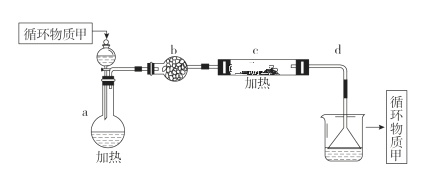
①上图中,装置a由________、________、双孔塞和导管组成。
②循环物质甲的名称是________。
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池己被广泛用作便携式电源。正极材料为LiCoO2、LiFePO4等,负极材料一般为石墨碳,以溶有LiPF6、LiBF4等的碳酸二乙酯(DEC)作电解液。
(1)Fe2+基态核外电子排布式为 ________。
(2)PO43-的空间构型为 ________ (用文字描述)。
(3)![]() 中
中![]() 的配位数为6,该配合物中的配位原子为 _____。
的配位数为6,该配合物中的配位原子为 _____。
(4)碳酸二乙酯(DEC)的分子结构如图所示,分子中碳原子的轨道杂化类型为_____,1mol碳酸二乙酯(DEC)中含有σ键的数目为_____。
![]()
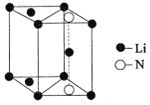
(5)氮化锂是一种新型无机贮氢材料,其晶胞结构如图所示,该晶体的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究某溶液中溶质 R的分解速率的影响因素,分别用三份不同初始浓度 R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法错误的是

A.25℃时,10~30min 内,R 的分解平均速率为 0.030 mol·L-1·min-1
B.对比 30℃和 10℃曲线,在同一时刻,能说明 R的分解速率随温度升高而增大
C.对比 30℃和 25℃曲线,在 0~50min 内,能说明R 的分解平均速率随温度升高而增大
D.对比 30℃和 10℃曲线,在 50min 时,R 的分解率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除 CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对 CO2 创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) △H=-41kJ/mol
H2(g)+CO2(g) △H=-41kJ/mol
②C(s)+2H2(g)![]() CH4(g) △H=-73kJ/mol
CH4(g) △H=-73kJ/mol
③2CO(g)![]() C(s)+CO2(g) △H=-17kJ/mol
C(s)+CO2(g) △H=-17kJ/mol
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____。
(2)目前工业上有一种方法是用 CO2来生产燃料甲醇。为探究该反应原理,在容积为 2L密闭容器中,充入1molCO2和 3.25molH2在一定条件下发生反应,测得 CO2、CH3OH(g)和 H2O(g)的物质的量(n)随时间的变化如图所示:
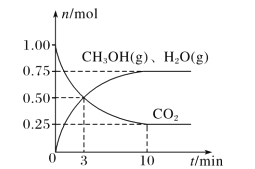
①从反应开始到平衡,氢气的平均反应速率v(H2)= ____。
②下列措施一定不能使CO2的平衡转化率增大的是____ (填字母)。
A.在原容器中再充入1molCO2
B.在原容器中再充入1molH2
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
F.将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g)H2(g)+CO2(g)的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
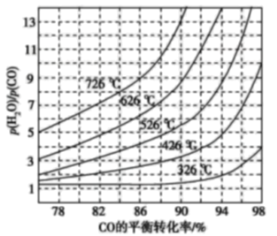
①上述反应的正反应方向是 ____(填“吸热”或“放热”)反应;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作 Kp),则在恒温密闭容器中,该反应的Kp与Kc的关系是 _______,如果提高p(H2O)/p(CO),则Kp_______ (填“变大”“变小”或“不变”);使用铁镁催化剂的实际工业流程中,一般采用400℃左右,p(H2O)/p(CO) =3~5,采取此条件的原因可能是 _________ 。
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述正确的是 ____(填字母)。
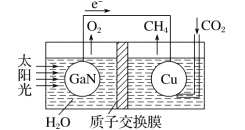
A.该装置能量转化形式仅存在太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.反应结束后,理论上溶液的 pH 值保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是
2 +KOH→
+KOH→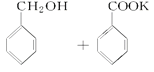
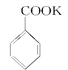 +HCl→
+HCl→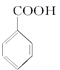 +KCl
+KCl
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃;苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
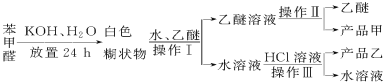
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是________,乙醚溶液中所溶解的主要成分是________。
(2)操作Ⅱ的名称是________。
(3)操作Ⅲ的名称是________,产品乙是________。
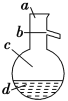
(4)如图所示,操作Ⅱ中温度计水银球上沿放置的位置应是________(填“a”“b”“c”或“d”),该操作中,除需蒸馏烧瓶、温度计外,还需要的玻璃仪器是__________________,得到产品甲的适宜温度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18 g·cm-3,其中镁离子的质量分数为5.1%,该溶液中氯离子的物质的量浓度为( )
A.0.5 mol·L-1B.2 mol·L-1
C.2.5 mol·L-1D.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列有机化合物的说法正确的是( )
A.![]() 、
、![]() 、
、![]() 互为同系物
互为同系物
B.有机化合物 的名称是2,3,5,5-四甲基-4-乙基己烷
的名称是2,3,5,5-四甲基-4-乙基己烷
C.有机化合物![]() 中最多有16个原子共面
中最多有16个原子共面
D.含有5个碳原子的饱和链烃,其一氯取代物有8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸分别和三种钠盐反应,下列分析正确的是

A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com