
【题目】在标准状况下:①6.72 LCH4;②3.01×1023个HCl分子;③13.6 gH2S;④0.2 molNH3,下列对这四种气体中含有氢原子数目从大到小表达正确的是( )
A.①③②④B.①③④②C.②③①④D.②④③①
【答案】B
【解析】
①标况下,6.72 LCH4的物质的量为![]() =0.3mol;
=0.3mol;
②3.01×1023个HCl分子的物质的量为![]() =0.5mol;
=0.5mol;
③13.6 gH2S的物质的量为![]() =0.4mol;
=0.4mol;
④0.2 molNH3,氢原子的物质的量为0.2mol×3=0.6mol;
①标况下,6.72 LCH4的物质的量为![]() =0.3mol,氢原子的物质的量为0.3×4=1.2mol,因此氢原子的数目为1.2NA;
=0.3mol,氢原子的物质的量为0.3×4=1.2mol,因此氢原子的数目为1.2NA;
②3.01×1023个HCl分子的物质的量为![]() =0.5mol,氢原子的物质的量为0.5mol,因此氢原子的数目为0.5NA;
=0.5mol,氢原子的物质的量为0.5mol,因此氢原子的数目为0.5NA;
③13.6 gH2S的物质的量为![]() =0.4mol,氢原子的物质的量为0.4mol×2=0.8mol,因此氢原子的数目为0.8NA;
=0.4mol,氢原子的物质的量为0.4mol×2=0.8mol,因此氢原子的数目为0.8NA;
④0.2 molNH3,氢原子的物质的量为0.2mol×3=0.6mol,因此氢原子的数目为0.6NA;
所以四种气体中含有氢原子数目从大到小的顺序为①③④②;
答案选B。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:
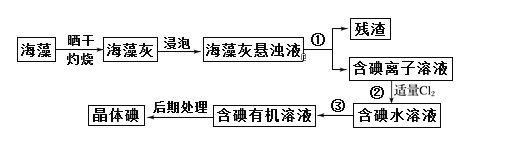
(1)实验室灼烧海带,需要用到的仪器:酒精灯、铁三脚架、________、泥三角。
(2)提取碘的过程中实验操作①的名称是_____________。
(3)操作③不可选择的有机试剂是___________。
A.四氯化碳 B.苯 C.酒精 D.汽油
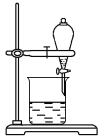
(4)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈___________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是______________________________。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过下列实验装置蒸馏。
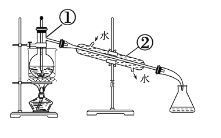
写出装置图中实验仪器①和②的名称:①_____________;②______________。
找出图中的错误之处:_______________________;________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙、丙三个体积均为2L的恒容密闭容器,按不同投料比Z[![]() 进行反应: 4HCl(g)+O2(g)
进行反应: 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
2Cl2(g)+2H2O(g) △H。在不同温度T条件下达到平衡时,HCl的平衡转化率与Z和T的关系如下表所示。
容器 | 起始时 | 平衡时HCl转化率 | |||
n(HCl)/mol | Z | T=100℃ | T=200℃ | T=300℃ | |
甲 | 0.8 | a | 96% | 94% | 90% |
乙 | 0.8 | b | 46% | 44% | 40% |
丙 | 0.8 | 4 | 95% | 88% | 80% |
下列说法正确的是
A.b<4
B.温度升高时,反应速率减慢,所以转化率下降
C.丙容器中,300℃平衡时,c(O2)=0.04molL-1
D.若甲容器温度在300时需要5min达到平衡,则此时间内v(Cl2)=0.036molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是
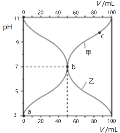
A.点c对应的溶液中有:c(B+)+c(BOH)=0.1molL-1
B.点b对应的溶液中有:c(B+)=c(A-)
C.曲线甲表示加入BOH溶液的体积与pH的关系曲线
D.在由点a到点c的过程,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨时,在某个密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g)
2NH3(g)
(1)下列能使反应速率加快的是_____________________
①升高温度 ②减小容器体积 ③通入N2 ④通入Ar使压强增大 ⑤通入HCl气体 ⑥加入合适的催化剂
A.①③④⑤ B.①②③⑥ C.①②③④ D.②④⑤⑥
(2)在恒温、恒容的条件下,下列说法能表示反应达到化学平衡状态的是__________
①当有1molN2被消耗,就有2molNH3生成
②当有6molH—H键形成时,就有12molN—H键形成
③2![]() 正(N2)=
正(N2)=![]() 逆(NH3)
逆(NH3)
④N2的物质的量不再变化
⑤H2、N2、NH3的浓度之比等于3:1:2
⑥混合气体的密度不变
⑦混合气体的压强不变
⑧混合气体的平均相对分子质量不变
A.①③④⑤⑦ B.①②③④⑧ C.②③④⑦⑧ D.②④⑤⑥
(3)在2 L定容密闭容器中通入1 mol N2(g)和3 mol H2(g),发生反应:3H2(g)+N2(g)![]() 2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。
2NH3(g)(放热反应)。测得压强-时间图像如图甲,测得p2=0.8p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如图乙图像。
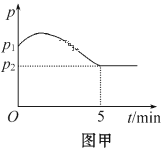
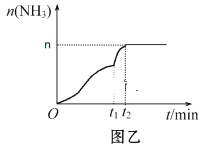
①如图甲,反应开始至平衡时NH3的平均反应速率为_____________________,平衡时氢气的转化率为_________。
②如图乙,下列说法正确的是_________
A.t1时刻可能是加入了催化剂
B.改变条件可以使H2 100℅转化为NH3
C.增大N2的浓度,可以提高H2的转化率
D.t2时刻,N2的浓度与NH3的浓度之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示的一些物质或概念间的从属关系中正确的是

X | Y | Z | |
A | 二氧化氮 | 酸性氧化物 | 氧化物 |
B | 硫酸 | 化合物 | 电解质 |
C | 胶体 | 分散系 | 混合物 |
D | 置换反应 | 氧化还原反应 | 离子反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】指出下列分子中带*号的原子采用的杂化方式:
(1)HO2________
(2) _________
_________
(3)*CO2________
(4)CHCH2OH_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)环氧乙烷(EO)是一种重要的化工原料,可用于生产乙二醇、乙醇胺等化工产品,目前乙烯直接氧化法被广泛应用于环氧乙烷的生产并得到广泛关注。制备环氧乙烷工艺装置如图: ,其中“反应床”中发生的反应有:
,其中“反应床”中发生的反应有:
主反应①:2CH2=CH2(g)+O2(g) ![]() 2
2![]() (g) △H1=-221.0kJ/mol;
(g) △H1=-221.0kJ/mol;
副反应②:CH2=CH2(g)+3O2(g) ![]() 2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
副反应③:2![]() (g)+5O2(g)
(g)+5O2(g) ![]() 4CO2(g)+4H2O(g) △H3;
4CO2(g)+4H2O(g) △H3;
副反应④:![]() (g)
(g)![]() CH3CHO(g) △H3=-115.0kJ/mol
CH3CHO(g) △H3=-115.0kJ/mol
已知:环氧乙烷选择性是指乙烯进行反应①生成环氧乙烷的优势
(1)写出反应③的△H3=______kJ/mol;
(2)下列有关环氧乙烷制备说法不正确的是______
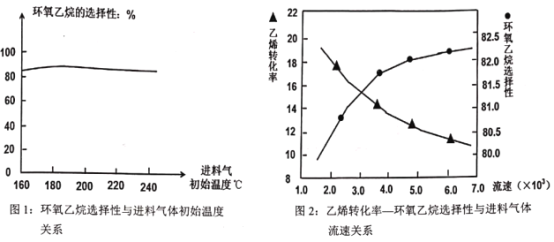
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降;主要是原料气与催化剂接触时间过短造成
C.图2表明,原料气的流速加快,环氧乙烷选择性略微增大;主要原因是温度得到较好控制,催化剂活性较强
D.若进料气中O2比例增大,环氧乙烷产率降低;其中主要原因是环氧乙烷转化为乙醛
(3)已知“反应床”中压强对乙烯转化率和环氧乙烷选择性的影响如图3:
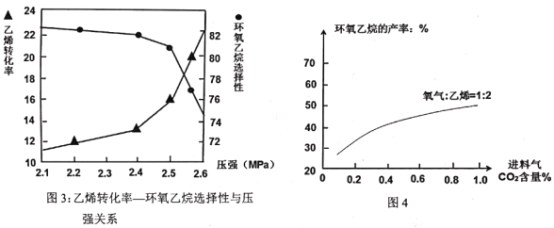
请解释当反应体系中压强高于2.4Mpa,导致环氧乙烷选择性下降的主要原因:______。
(4)不同进料组分,环氧乙烷产率不同;其中进料气n(O2):n(C2H4)=1:2时,随CO2含量变化,环氧乙烷的产率变化如图4。请在图4上画出进料气n(O2):n(C2H4)=3:1时,随CO2含量变化,环氧乙烷的产率变化曲线_______。
(二)环氧丙烷是一种重要的化工原料,且广泛用途。有机电化学法电解合成环氧丙烷是一种常见的生成工艺;其原理是将丙烯与电解饱和食盐水的电解产物反应,转化为氯丙醇(CH3CHOHCH2Cl),氯丙醇进一步反应生成环氧丙烷。其电解简易装置如图。
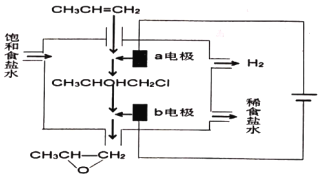
(1)写出a电极的电极反应式:__________;
(2)写出b电极区域生成环氧丙烷的化学方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com