
【题目】(一)环氧乙烷(EO)是一种重要的化工原料,可用于生产乙二醇、乙醇胺等化工产品,目前乙烯直接氧化法被广泛应用于环氧乙烷的生产并得到广泛关注。制备环氧乙烷工艺装置如图: ,其中“反应床”中发生的反应有:
,其中“反应床”中发生的反应有:
主反应①:2CH2=CH2(g)+O2(g) ![]() 2
2![]() (g) △H1=-221.0kJ/mol;
(g) △H1=-221.0kJ/mol;
副反应②:CH2=CH2(g)+3O2(g) ![]() 2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
副反应③:2![]() (g)+5O2(g)
(g)+5O2(g) ![]() 4CO2(g)+4H2O(g) △H3;
4CO2(g)+4H2O(g) △H3;
副反应④:![]() (g)
(g)![]() CH3CHO(g) △H3=-115.0kJ/mol
CH3CHO(g) △H3=-115.0kJ/mol
已知:环氧乙烷选择性是指乙烯进行反应①生成环氧乙烷的优势
(1)写出反应③的△H3=______kJ/mol;
(2)下列有关环氧乙烷制备说法不正确的是______
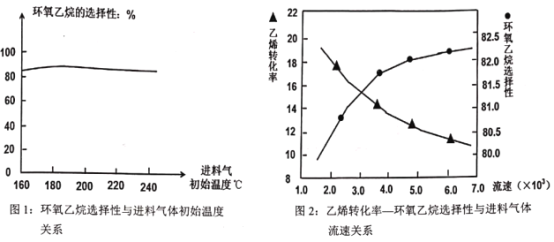
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降;主要是原料气与催化剂接触时间过短造成
C.图2表明,原料气的流速加快,环氧乙烷选择性略微增大;主要原因是温度得到较好控制,催化剂活性较强
D.若进料气中O2比例增大,环氧乙烷产率降低;其中主要原因是环氧乙烷转化为乙醛
(3)已知“反应床”中压强对乙烯转化率和环氧乙烷选择性的影响如图3:
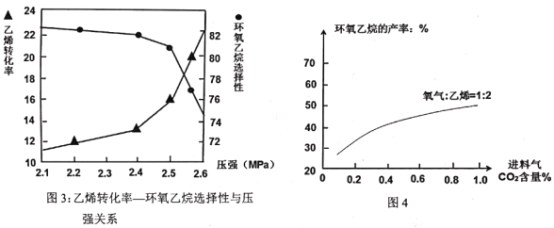
请解释当反应体系中压强高于2.4Mpa,导致环氧乙烷选择性下降的主要原因:______。
(4)不同进料组分,环氧乙烷产率不同;其中进料气n(O2):n(C2H4)=1:2时,随CO2含量变化,环氧乙烷的产率变化如图4。请在图4上画出进料气n(O2):n(C2H4)=3:1时,随CO2含量变化,环氧乙烷的产率变化曲线_______。
(二)环氧丙烷是一种重要的化工原料,且广泛用途。有机电化学法电解合成环氧丙烷是一种常见的生成工艺;其原理是将丙烯与电解饱和食盐水的电解产物反应,转化为氯丙醇(CH3CHOHCH2Cl),氯丙醇进一步反应生成环氧丙烷。其电解简易装置如图。
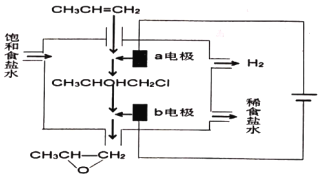
(1)写出a电极的电极反应式:__________;
(2)写出b电极区域生成环氧丙烷的化学方程式:__________。
【答案】-2435 AD I.压强增大,主、副反应速率增加,从而导致反应体系升温;温度升高导致副反应速率比主反应速率提高的更多,环氧乙烷的选择性降低;
II.压强增大,副反应③逆向移动,环氧乙烷浓度,增大导致反应①进行不利,环氧乙烷选择性降低;  2Cl--2e-=Cl2↑ CH3CHOHCH2Cl+NaOH→
2Cl--2e-=Cl2↑ CH3CHOHCH2Cl+NaOH→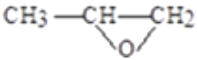 +NaCl+H2O
+NaCl+H2O
【解析】
(1) 主反应①:2CH2=CH2(g)+O2(g) ![]() 2
2![]() (g) △H1=-221.0kJ/mol;
(g) △H1=-221.0kJ/mol;
副反应②:2CH2=CH2(g)+3O2(g) ![]() 2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
副反应③:2![]() (g)+5O2(g)
(g)+5O2(g) ![]() 4CO2(g)+4H2O(g) △H3;将方程式②×2-①得到反应③,则△H3进行相应的改变;
4CO2(g)+4H2O(g) △H3;将方程式②×2-①得到反应③,则△H3进行相应的改变;
(2)A.升高温度,平衡向吸热方向移动;
B.流速越快,反应物接触时间越短;
C.原料气的流速加快,环氧乙烷选择性略微增大;主要原因是温度得到较好控制,催化剂活性较强;
D.若进料气中O2比例增大,环氧乙烷产率降低,其中主要原因是环氧乙烷转化为二氧化碳和水;
(3)I.压强增大,主副反应速率增加,导致体系温度升高;温度升高导致副反应速率比主反应速率提高更多;
II.压强增大,副反应③逆向移动,环氧乙烷浓度增大;
(4)增大氧气的量,促进副反应发生,环氧乙烷的选择性降低,随着二氧化碳含量增大,环氧乙烷选择性增大。
(二)(1)a连接电源正极,应为电解池阳极,发生氧化反应生成氯气;
(2)b为阴极,CH3CHOHCH2Cl与氢氧化钠溶液反应生成环氧丙烷和NaCl。
(1) 主反应①:2CH2=CH2(g)+O2(g) ![]() 2
2![]() (g) △H1=-221.0kJ/mol;
(g) △H1=-221.0kJ/mol;
副反应②:2CH2=CH2(g)+3O2(g) ![]() 2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
2CO2(g)+2H2O(g) △H2=-1323.0kJ/mol;
副反应③:2![]() (g)+5O2(g)
(g)+5O2(g) ![]() 4CO2(g)+4H2O(g) △H3;根据盖斯定律计算②×2-①得到2(g)+5O2(g)4CO2(g)+4H2O(g)△H3=[2(-1323.0)+211.0]kJ/mol=-2435kJ/mol;
4CO2(g)+4H2O(g) △H3;根据盖斯定律计算②×2-①得到2(g)+5O2(g)4CO2(g)+4H2O(g)△H3=[2(-1323.0)+211.0]kJ/mol=-2435kJ/mol;
(2)A.升高温度平衡向吸热方向移动,主反应是放热反应,升高温度平衡逆向移动,导致乙烯转化率降低,A错误;
B.流速越快,反应物接触时间越短,消耗的乙烯越少,则乙烯转化率下降,B正确;
C.主反应是放热反应,升高温度平衡逆向移动,导致乙烯转化率减小,但是原料气的流速加快,环氧乙烷选择性略微增大,则主要原因是温度得到较好控制,催化剂活性较强,C正确;
D.若进料气中O2比例增大,环氧乙烷产率降低,其中主要原因是环氧乙烷转化为二氧化碳和水,D错误;
故合理选项是AD;
(3)I.压强增大,主、副反应速率增加,从而导致反应体系升温;温度升高导致副反应速率比主反应速率提高的更多,环氧乙烷的选择性降低;
II.压强增大,副反应③逆向移动,环氧乙烷浓度增大,导致反应①进行不利,环氧乙烷选择性降低;
(4)增大氧气的量,促进副反应发生,环氧乙烷产率降低,随着二氧化碳含量增大,环氧乙烷选择性增大,所以其图象为 ;
;
(二)(1)a连接电源正极,作电解池阳极,发生氧化反应产生Cl2,电极方程式为2Cl--2e-Cl2↑;
(2)b为阴极,生成NaOH,CH3CHOHCH2Cl与氢氧化钠溶液反应生成环氧丙烷和NaCl,方程式为CH3CHOHCH2Cl+NaOH→![]() +NaCl+H2O。
+NaCl+H2O。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下:①6.72 LCH4;②3.01×1023个HCl分子;③13.6 gH2S;④0.2 molNH3,下列对这四种气体中含有氢原子数目从大到小表达正确的是( )
A.①③②④B.①③④②C.②③①④D.②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:某些强酸盐的水溶液呈中性,如NaCl溶液,某些弱酸盐的水溶液呈碱性,如Na2CO3溶液。请根据如下图所示转化关系回答有关问题。A和B均为焰色反应呈黄色的水溶液,A呈中性,B呈碱性并具有强氧化性。
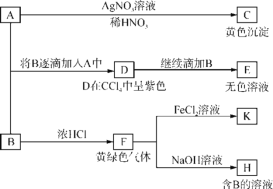
(1)写出C的化学式:________。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式: ___________________,_____________________。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:____________。
(4)检验K溶液中阳离子的简易方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物X由四种常见的元素组成,为探究其成分,某学生进行如下实验:
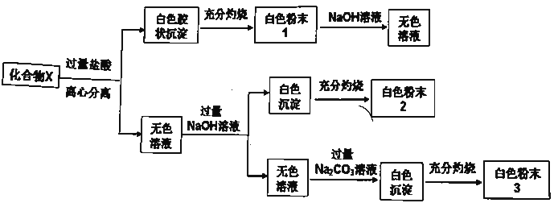
①20.8gX固体进行实验,得到白色粉末1质量12.0g,白色粉末2质量为6.0g;
②白色粉末2可用作耐高温材料,白色粉末3是一种常见干燥剂;请回答问题:
(1)X中金属元素的名称是______。
(2)化合物X与足量盐酸反应离子方程式______。
(3)在高温条件下,白色粉末2中某元素单质与白色粉末1反应,是工业制备另一种单质方法之一,写出该反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组按下列路线合成重要有机物的中间体J
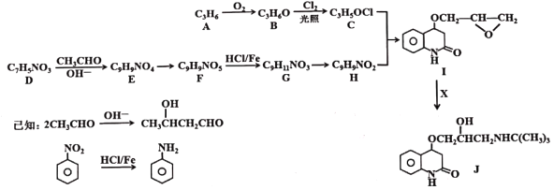
(1)下列说法不正确的是______。
A.化合物A→B的反应类型为加成反应
B.化合物F能发生取代、加成、消去等反应
C.化合物G可以形成内盐
D.化合物J的分子是C16H22N2O3
(2)化合物E的结构简式是_____。
(3)C+H→I的化学方程式是______。
(4)写出化合物X同时满足下列条件的同分异构体的结构简式______。IR谱检测表明:分子中不存在-NH2
(5)以CH2=CH2和HCHO为原料制备C(CH2OH)4,请设计合成路线(用流程图表示,无机试剂任选)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示
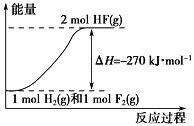
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质A-F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;适当的条件下,它们之间可以发生如图所示的转化。
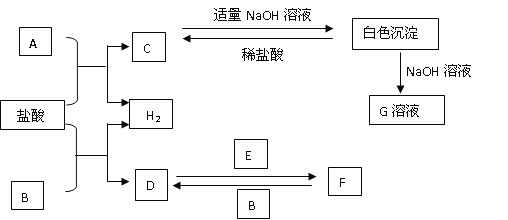
(1)A的原子结构示意图___;G溶液中溶质的化学式为___。
(2)请写出反应D→F的化学方程式:___。
(3)检验F中金属阳离子的常用试剂是___(填物质的化学式);现象是___。
(4)E物质可与石灰乳反应制取漂白粉,写出漂白粉的有效成分___。
(5)写出C与足量氢氧化钠溶液反应的离子方程式___。
(6)FeCl3溶液和氢氧化铁胶体的本质区别是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com