
【题目】已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现血红色。

(1)物质A的化学式为 ________,F化学式为 ________;
(2)B和R在溶液中反应生成F的离子方程式为__________________________;
(3)H在潮湿空气中变成M的实验现象是________,化学方程式为______________;
(4)A和水反应生成B和C的化学方程式为__________________________,由此反应可知A有作为_________的用途;
(5)W溶液中滴加KSCN溶液出现血红色的离子方程式______________________。
【答案】Na2O2 H2 2Al + 2OH- + 2H2O=2AlO2-+ 3H2↑ 白色沉淀迅速变为灰绿色,最终变为红褐色 4Fe(OH)2 + 2H2O + O2 =4Fe(OH)3 2Na2O2 + 2H2O =4NaOH + O2↑ 供氧剂 Fe3+ +3SCN-= Fe(SCN)3
【解析】
已知A为淡黄色固体,能和水反应生成B和C,则A是过氧化钠。R是地壳中含量最多的金属元素的单质,R是Al,T为生活中使用最广泛的金属单质,T是铁,D是具有磁性的黑色晶体,D是四氧化三铁;C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色,则W含有铁离子,过氧化钠与水反应生成B和C,铁与C反应生成Fe3O4,所以C为O2,B为NaOH,D与盐酸反应再与铁反应生成E为FeCl2,B与E反应生成H为Fe(OH)2,H与潮湿的空气反应生成M为Fe(OH)3,M与盐酸反应生成W为FeCl3,氢氧化钠与铝反应生成F为H2,据此解答。
根据以上分析可知A是过氧化钠,B为NaOH,C为O2,D是四氧化三铁,E为FeCl2,F为H2,H为Fe(OH)2,M为Fe(OH)3,R是Al,T是铁,W为FeCl3,则
(1)物质A是过氧化钠,化学式为Na2O2,F的化学式为H2;
(2)B和R在溶液中反应生成F,即铝和氢氧化钠溶液反应生成偏铝酸钠和氢气的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)Fe(OH)2在潮湿空气中变成Fe(OH)3的反应现象为:白色沉淀迅速变为灰绿色,最终变为红褐色,反应的化学方程式为4Fe(OH)3+O2+2H2O=4Fe(OH)3;
(4)过氧化钠和水反应生成氢氧化钠和氧气的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,由此反应可知过氧化钠有作为供氧剂的用途;
(5)氯化铁溶液中滴加KSCN溶液出现血红色的离子方程式为Fe3++3SCN-=Fe(SCN)3。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如图所示。据图判断不正确的是( )
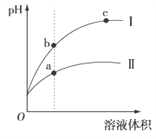
A. I是盐酸,Ⅱ是醋酸
B. 稀释前等体积的I、Ⅱ溶液中和氢氧化钠的能力相同
C. a、b、c三点KW的数值相同
D. 溶液的导电性a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 mol Na2O2与2mol NaHCO3固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A. NaOH和Na2CO3 B. NaOH
C. Na2CO3 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)(CH3)2CHCH(CH3)2的系统命名为___________________;
(2)有机物的结构可用“键线式”简化表示,CH3-CH=CH-CH3的键线式为________;
(3)下列化合物分子中,在核磁共振氢谱图中能给出一种信号的是(______)
A.CH3CH2CH3 B. CH3COCH2CH3 C.CH3CH2OH D.CH3OCH3
(4)分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是 (______)
A.红外光谱 B. 1H核磁共振谱 C.质谱法 D.与钠反应
(5)已知乙烯分子是平面结构, 1,2-二氯乙烯可形成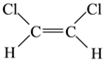 和
和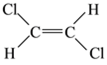 两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是(_____)
两种不同的空间异构体,称为顺反异构。下列能形成类似上述空间异构体的是(_____)
A.1-丙烯 B.4-辛烯 C.1-丁烯 D.2-甲基-1-丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下图所示A、B、C、D四种仪器,写出名称:
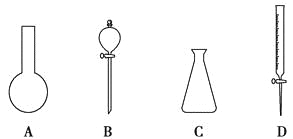
A. ,B. ,
C. ,D. 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气。在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂”处理的有 (填序号)。
(3)以下是中学化学实验中常见的定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平
①其中标有仪器使用温度的是 (填编号)。
②实验时用来精确量取液体体积的是 (填编号)。
③使用前要检查仪器是否漏液的是 (填编号)。
(4)玻璃棒的作用主要有以下四种:①搅拌、②引流、③蘸取溶液、④转移固体。不同实验中其作用可能不完全相同,请回答下列问题:
A.在“用无水碳酸钠配制100 mL 0.12 mol·L-1的碳酸钠溶液”的实验中,玻璃棒的作用是 (填写编号)。
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以制得纯净的食盐”的实验中玻璃棒的作用可能是 (填写编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1-溴丁烷的原理为CH3CH2CH2CH2OH+NaBr+H2SO4![]() CH3CH2CH2CH2Br+NaHSO4+H2O,根据原理设计实验装置如图1所示(夹持装置已略去)
CH3CH2CH2CH2Br+NaHSO4+H2O,根据原理设计实验装置如图1所示(夹持装置已略去)
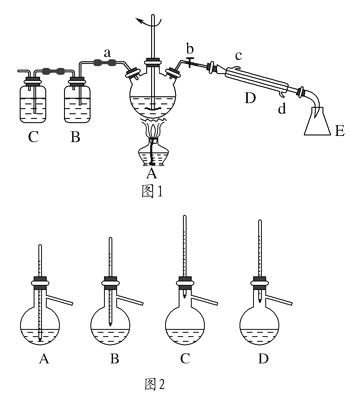
(1)仪器D的名称为________,使用玻璃棒搅拌的目的是__________________。
(2)1-溴丁烷的制备反应中可能有:________、________、溴化氢等副产物生成。熄灭图1中A装置中的酒精灯,打开a,余热会使反应继续进行。B、C装置可检验部分副产物,则B、C装置中所盛放的试剂分别是________、________。
(3)为了精制1-溴丁烷,待烧瓶冷却后,将A装置中的玻璃棒换成温度计,关闭a,打开b,使冷水从________(填“c”或“d”)处流入。对粗产品进行蒸馏提纯时,图2装置中温度计的位置正确的是________(填字母,下同),可能会导致收集到的产品中混有低沸点杂质的装置是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
B. 某温度下,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液一定显中性
C. 向苯和少量苯酚的混合溶液中加入适量浓溴水,过滤,可除去苯中少量苯酚
D. 已知I3-![]() I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
NH4++NH2-.某温度下,液氨的离子积常数K=c(NH4+)·c(NH2-)=1.6×10-29,若用定义pH一样来规定pN=-lg c(NH4+),则在该温度下,下列叙述正确的是
A. 纯净的液氨中,pN=7
B. 液氨达到电离平衡时c(NH3)=c(NH4+)+c(NH2-)
C. 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3
D. 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在加热条件下,用二氧化锰与足量浓盐酸反应,制得氯气0.56L(标准状况)。问:
(1)理论上需要消耗MnO2的质量为__________。
(2)被氧化的HCl的物质的量是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com