
 A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在G中非金属与金属元素的原子个数比为1:2.
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在G中非金属与金属元素的原子个数比为1:2. ;E为CO2,分子中C原子与O原子之间形成2对共用电子对,其结构式是O=C=O,
;E为CO2,分子中C原子与O原子之间形成2对共用电子对,其结构式是O=C=O, ;O=C=O;
;O=C=O;

科目:高中化学 来源: 题型:
| A、常温下干燥的Cl2能用钢瓶贮存 |
| B、14C可用于文物的年代鉴定,14C与12C互为同素异形体 |
| C、BaSO4 在医学上用作钡餐,Ba2+对人体无毒 |
| D、煤的干馏和石油的分馏均属化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
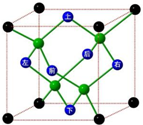 冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
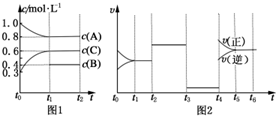 向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.
向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com