
【题目】下列物质转化一定要加入还原剂才能实现的是( )
A.SO32-→SO2 B.SO2→S C.Cl2→HCl D.Na2O2→O2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列化学用语正确的是
A. NaHCO3的水解方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸铵的电离:CH3COONH4![]() CH3COO-+NH4+
CH3COO-+NH4+
C. 氯化银的溶解平衡表达式:AgCl(s) ![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
D. 汽车尾气净化反应2NO+2CO=2CO2+N2能够自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:

资料:溴单质容易挥发。
(1)写出“氧化”时的离子方程式_______。
(2)写出第1步“吸收”时的离子方程式________________,该反应体现了SO2的____性。
(3)得到的“含Br2溶液”通过以下不同操作,都可得到溴单质:
① 直接蒸馏得到溴单质,该操作利用的是溴的何种性质:___________;
② 加入四氯化碳萃取,将得到的溴的四氯化碳溶液蒸馏得到溴单质。可以用四氯化碳对溴溶液进行萃取利用的是溴的何种性质:_______________。
(4)对虚线框中的流程进行整体分析,完整说明该流程中所有操作的目的是___________。
(5)工业可用Na2CO3溶液代替二氧化硫的水溶液吸收Br2,完成下列化学反应方程式:
___Br2+___Na2CO3=___NaBrO3+____CO2+__ ______
若有480g溴完全反应,转移电子的物质的量为__________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2mol NO2,发生下列反应2NO2(g) ![]() N2O4(g) ΔH < 0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图。下列对t1时刻改变条件的推测中正确的是
N2O4(g) ΔH < 0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图。下列对t1时刻改变条件的推测中正确的是
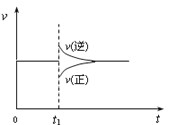
A.保持压强不变,升高反应温度
B.保持温度和容器体积不变,充入1mol N2(g)
C.保持温度和容器体积不变,充入1mol N2O4 (g)
D.保持温度和压强不变,充入1mol N2O4 (g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某充电宝属于锂钒氧化物凝胶电池,电池总反应为V2O4+xLi![]() LixV2O4,下列说法正确的是
LixV2O4,下列说法正确的是
A. 放电时正极上的电极反应为:V2O4+xe-+ xLi+ =LixV2O4
B. 该充电宝的凝胶介质也可用KOH溶液代替
C. 充电时电池的正极得到电子后LixV2O4转化为 V2O4
D. 放电时每消耗7gLi,就会有1mol电子通过凝胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)常温时,AlCl3的水溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):________________________。AlCl3溶液蒸干并灼烧得到的物质是__________(填化学式)。
(2)泡沫灭火器灭火时发生反应的离子方程是____________;
(3)为了使Na2S溶液中![]() 的比值变小,可加入的物质是_______
的比值变小,可加入的物质是_______
A.适量盐酸 B.适量NaOH溶液
C.适量KOH溶液 D.适量蒸馏水
(4)已知25℃ 时,Ksp[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02molL-1,如要生成Cu(OH)2 沉淀,应调整溶液的pH,使之大于______________。
(5)已知c(Ca2+)≤10-5 mol·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9。在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(CO![]() )=10-3 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。
)=10-3 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.所有卤代烃都难溶于水,且都是密度比水大的液体
B.所有卤代烃都是通过取代反应制得
C.卤代烃不属于烃类
D.卤代烃都可发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)=___________。
(2)HA的电离平衡常数K=______________;
(3)由HA电离出的c(H+)约为水电离出的c(H+)的________倍。
Ⅱ.室温下,有一pH = 12的NaOH溶液100 mL ,欲使它的pH降为11。
(1)如果加入蒸馏水,就加入__________mL
(2)如果加入pH = 10的NaOH溶液,应加入_________ mL
(3)如果加入0.008 mol/L HCl溶液,应加入___________ mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com