
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
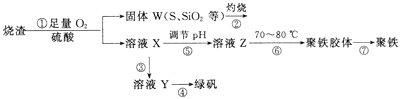
(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是_____(填标号)。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为_________。
(3)过程③中,需加入的物质是__________。
(4)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2. 800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3. 495 g。若该聚铁主要成分为[Fe(OH) (SO4)]n,则该聚铁样品中铁元素的质量分数为____________(假设杂质中不含铁元素和硫元素)。
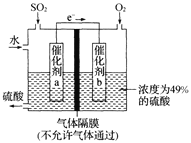
(5)如图是将过程②产生的气体SO2转化为重要的化工原料H2SO4的原理示意图,若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为______。
【答案】B 4 FeS+3O2+12 H+=== 4Fe3++6H2O+4S Fe(或铁) 30% 8 : 15
【解析】
过程②产生的气体为![]() ,具有还原性和漂白性;根据反应物和生成物的种类结合质量守恒书写化学方程式;溶液X中含有
,具有还原性和漂白性;根据反应物和生成物的种类结合质量守恒书写化学方程式;溶液X中含有![]() ,要制备绿矾,应加入
,要制备绿矾,应加入![]() 使之还原为
使之还原为![]() ;
;
(1)过程②产生的气体为![]() ,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性
,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性![]() 溶液、溴水褪色,只有紫色石蕊试液不会褪色。
溶液、溴水褪色,只有紫色石蕊试液不会褪色。
故答案为:B;
(2)反应物为![]() 、
、![]() 和
和![]() ,生成物有
,生成物有![]() ,根据质量守恒还应有
,根据质量守恒还应有![]() 和
和![]() ,反应的离子方程式为
,反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
(3)溶液X中含有![]() ,要制备绿矾,应加入
,要制备绿矾,应加入![]() 使之还原为
使之还原为![]() ,加入铁可生成
,加入铁可生成![]() ,并且不引入新的杂质,
,并且不引入新的杂质,
故答案为:Fe(或铁);
(4)过滤、洗涤、干燥,称量,得固体质量为3.495g,应为BaSO4沉淀,![]() ,则
,则![]() ,
,![]() ,该聚铁样品中铁元素的质量分数
,该聚铁样品中铁元素的质量分数![]() ,
,
故答案为:30%
(5)原硫酸浓度为49%,得到的硫酸浓度仍为49%,所以新生成的硫酸的质量比后加入物质的总质量为49%,总方程式为:![]() ,设加入
,设加入![]() 的质量为x g,加入水的质量为y g,需要通入氧气的质量为:
的质量为x g,加入水的质量为y g,需要通入氧气的质量为:![]() g,新生成硫酸的质量为
g,新生成硫酸的质量为![]() g,故
g,故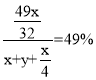 ,解得
,解得![]() ,
,
故答案为:8 : 15。


科目:高中化学 来源: 题型:
【题目】下列对有机物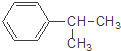 的叙述中,不正确的是( )
的叙述中,不正确的是( )
A. 它难溶于水,但易溶于苯
B. 该物质含苯环的同分异构体(不包括它本身)共有5种
C. 它会使酸性高锰酸钾溶液褪色
D. 一定条件下以和浓硝酸、浓硫酸的混合物发生硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的数值,下列说法正确的是( )
为阿伏加德罗常数的数值,下列说法正确的是( )
A.电解精炼铜时,若阳极质量减少![]() ,则转移到阴极的电子数不一定等于
,则转移到阴极的电子数不一定等于![]()
B.![]() 晶体中共含有
晶体中共含有![]() 个离子
个离子
C.![]() 的
的![]() 水溶液中含有的氧原子数为
水溶液中含有的氧原子数为![]()
D.常温下![]() 的
的![]() 溶液中,
溶液中,![]() 的浓度为
的浓度为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现用物质的量浓度为a mol/L的标准盐酸去测定VmL NaOH溶液的物质的量浓度,请填写下列空白:
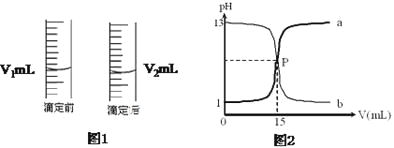
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是:____________________。
(2)如果用酚酞做指示剂,试判断到达滴定终点的实验现象是____________________。
(3)如图1是酸式滴定管中液面在滴定前后的读数,c(NaOH)=____________mol/L。
(4)若滴定前滴定管尖嘴部分留有有气泡,滴定后气泡消失,则测定的NaOH溶液的物质的量浓度________(填“偏高”、“偏低”或“不影响”)。
II.如图2是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
(1)曲线a是用__________溶液滴定____________溶液
(2)P点的坐标为(_______)
(3)盐酸的物质的量浓度为________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。为确认溶液组成进行如下实验:
。为确认溶液组成进行如下实验:
(1)![]() 上述溶液,加入足量
上述溶液,加入足量![]() 溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀
溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀![]() ,向沉淀中加入过量的盐酸,有
,向沉淀中加入过量的盐酸,有![]() 沉淀不溶。
沉淀不溶。
(2)向(1)的滤液中加入足量的![]() 溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体
溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体![]() (已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是( )
(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是( )
A.![]()
B.如果上述6种离子都存在,则![]()
C.一定存在![]() 、
、![]() 、
、![]() ,可能存在
,可能存在![]() 、
、![]() 、
、![]()
D.一定存在![]() 、
、![]() 、
、![]() 、
、![]() ,一定不存在
,一定不存在![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异秦皮啶具有镇静安神抗肿瘤功效,秦皮素具有抗痢疾杆菌功效。他们在一定条件下可发生转化,如图所示,有关说法正确的是
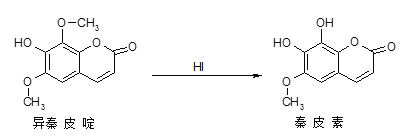
A.异秦皮啶与秦皮素互为同系物
B.1mol秦皮素最多可与4mol NaOH反应
C.鉴别异秦皮啶与秦皮素可用FeCl3溶液
D.上述反应为还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国电池的年市场消费量约为80亿只,其中70%是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺如下图所示:
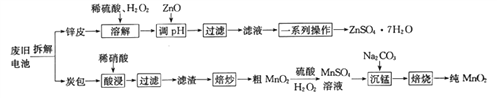
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等。
②Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38。
(1)除去炭包中碳粉的操作为_____________。
A.酸浸 B.过滤 C.焙炒 D.焙烧
(2)粗MnO2转化为MnSO4时,主要反应的离子方程式为_____________________。
(3)焙烧时发生反应的化学方程式为_____________。
(4)制备硫酸锌晶体流程中,用ZnO调节溶液pH的目的是______________________________,若溶解时不加H2O2带来的后果是____________________。
(5)“草酸钠-高锰酸钾返滴法”可测定MnO2的纯度:取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1mol·L-1Na2C2O4溶液(足量),最后用c2mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为_____________。
②该样品中MnO2的质量分数为__________________(假定杂质不参与反应,列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.将含有2NA个![]() 的
的![]() 溶液完全蒸干,得到
溶液完全蒸干,得到![]() 固体
固体
B.常温下,![]() 的
的![]() 溶液中含有的
溶液中含有的![]() 数目为0.2NA
数目为0.2NA
C.![]() 和足量S在加热条件下完全反应,转移的电子数为NA
和足量S在加热条件下完全反应,转移的电子数为NA
D.常温下,将![]() 铝片投入足量浓硫酸中,最终生成的
铝片投入足量浓硫酸中,最终生成的![]() 分子数为1.5NA
分子数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是造成大气污染的主要有害气体之一,二氧化硫尾气处理的方法之一是采用钠—钙联合处理法。
第一步:用NaOH溶液吸收SO2。2NaOH+SO2→Na2SO3+H2O
第二步:将所得的Na2SO3溶液与生石灰反应。Na2SO3+CaO+H2O→CaSO3↓+2NaOH
完成下列填空:
(1)在上述两步反应所涉及的短周期元素中,原子半径由小到大的顺序是__________。
(2)氧和硫属于同族元素,该族元素的原子最外层电子排布可表示为__________。写出一个能比较氧元素和硫元素非金属性强弱的化学反应方程式:_______________
(3)NaOH的电子式为_____________。
(4)若在第一步吸收SO2后得到的NaOH和Na2SO3混合溶液中,加入少许溴水,振荡后溶液变为无色,生成Na2SO4和NaBr。写出发生反应的化学方程式。_____________
(5)钠—钙联合处理法的优点有__________、____________。(任写两点)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com