
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
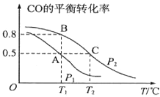
①A、B两点对应的压强大小关系是PA___PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是___。
③下列叙述能说明上述反应能达到化学平衡状态的是___(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=___。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)___v(逆)(填“>、<或=”)。
【答案】< KA=KB>KC b 100 >
【解析】
(1)①根据压强对化学平衡的影响分析;
②根据温度对化学平衡的影响分析可得;
③根据化学平衡状态特征:正逆反应速率相等,各组分含量保持不变分析;
(2)根据“三段式”计算P1压强、T1℃时反应的K;
(3),温度不变K不变,比较T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol的浓度商,与K比较可得。
(1)①反应CO(g)+2H2(g)CH3OH(g),是气体体积减小的反应,加压反应物转化率增大,所以PA<PB;
②据图分析,随温度升高CO转化率降低,说明正反应放热,升温平衡逆向移动,平衡常数减小,同一温度平衡常数相同,所以KA=KB>KC;
③a.H2的消耗速率是CH3OH生成速率的2倍,都是正反应速率,不能说明反应达到平衡状态,故a错误;
b.CH3OH的体积分数不再改变说明正逆反应速率相等,反应达到平衡状态,故b正确;
c.容器体积和气体质量始终不变,所以混合气体的密度始终不变,所以密度不变不能说明反应达到平衡状态,故c错误;
d.CO和甲醇的化学计量数都为1,所以CO和CH3OH的物质的量之和始终保持不变,所以这不能说明反应达到平衡状态,故d错误;
故答案为b;
(2) 在P1压强、T1℃时,容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g)CH3OH(g),CO的转化率为0.5,列三段式有:

此温度下,反应的K=![]() =100;
=100;
(3)温度不变,K不变,T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时Qc=![]() =50<K,反应正向着正方向进行,v(正)>v(逆)。
=50<K,反应正向着正方向进行,v(正)>v(逆)。


科目:高中化学 来源: 题型:
【题目】溶液X中含有下表离子中的某5种,且其浓度均为0.1 mol·L1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是( )
阳离子 | 阴离子 |
Na+、Fe3+、Fe2+、Mg2+ | NO3-、HCO3-、CO32-、SO42-、Cl- |
A.X溶液中一定含Fe3+、Fe2+
B.X溶液中不可能含有HCO3-或CO32-
C.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+===3Fe3++NO ↑ +2H2O
D.根据电荷守恒,原溶液中一定含Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将 0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H = -38.6kJ·mol-1
2NH3(g) △H = -38.6kJ·mol-1
C.HCl 和 NaOH 反应的中和热△H=-57.3 kJ·mol-1 ,则H2SO4和Ba(OH)2反应的中和热 △H = 2×(-57.3)kJ·mol -1
D.在101kPa 时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1) △H =-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0的化学平衡常数K=1,相同条件下,当c(CO2)=0.5mol/L,c(H2)=0.5mol/L,c(CO)=1mol/L,c(H2O)=1mol/L时,下列说法正确的是( )
A. 处于平衡状态,正逆反应速率相等B. 改变条件后,化学平衡常数一定改变
C. 反应逆向进行,正反应速率小于逆反应速率D. 升高温度,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种(不考虑溶液中含的较少的H+和OH-)Na+、NH4+、SO42-、CO32-、NO3-。取200mL该溶液,分为等体积的二份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33克。下列说法正确的是( )
A.该溶液中不一定含有Na+
B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3-
D.该溶液中一定含Na+,且c(Na+)≥0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下:

经操作I得到粗胆矾,操作III得到精制胆矾。两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
已知:![]() 、
、![]() 、
、![]() 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
|
|
| |
开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
(1)溶解、过滤需要用到玻璃棒,它的作用是________。
(2)写出加入3% H2O2后发生反应的离子方程式_______。(原溶液显酸性)。
(3)加稀氨水调节pH应调至范围______。下列物质可用来替代稀氨水的是___。(填字母)
A.NaOH B.Cu(OH)2C.CuO D.NaHCO3
(4)操作III析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、________________。
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
第一次实验 | 第二次实验 | |
坩埚质量(g) | 14.520 | 14.670 |
坩埚质量 | 17.020 | 18.350 |
第一次加热、冷却称量(g) | 16.070 | 16.989 |
第二次加热、冷却、称量(g) | 16.070 | 16.988 |
两次都无须再做第三次加热、冷却、称量,理由是______,该生此次实验的相对误差为__%(保留1位小数),产生实验误差的原因可能是___(填字母)。
A.加热前称量时坩埚未完全干燥 B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却 D.玻璃棒上沾有的固体未刮入坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①Fe+Cu2+=Fe2++Cu
②Ba2++2OH-+2H++SO42—=BaSO4↓+2H2O
③Cl2+H2O![]() H++Cl—+HClO
H++Cl—+HClO
④CO32-+2H+=CO2↑+H2O
⑤Ag++Cl-= AgCl↓
A.①②③④⑤B.①②③C.②③D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如下:
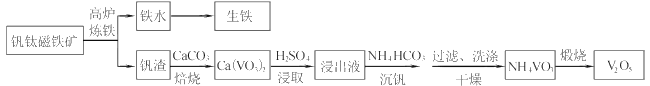
已知:①VO3-+2H+![]() VO2++H2O
VO2++H2O
②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(1)高炉炼铁应用的冶炼方法是____(填标号)
A.热分解法 B.热还原法 C.电解法
(2)钒渣中的V2O3在焙烧时转化为Ca(VO3)2,写出该反应的化学方程式__。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_,浸出液中含钒物质的化学式为___。
(4)沉钒过程有气体生成,其反应的离子方程式为__。
(5)过滤后用乙醇代替水来洗涤沉淀的原因是__。
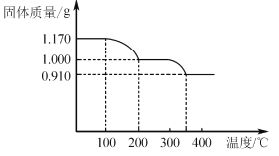
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为__,300~350℃放出的气态物质化学式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com