
【题目】石墨烯(如图a)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图b)。
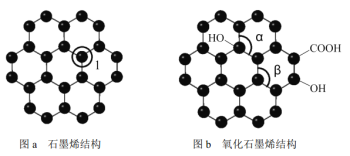
(1)图a中,1号C与相邻C形成σ键的个数为___________,该C原子杂化方式是______;图b中键角α_________键角β。(填“>” 、 “<” 或“=” )
(2)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有_______(填元素符号)。
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列有关胆矾的说法正确的是( )
A. Cu2+的价电子排布式为3d84s1
B. 所有氧原子都采取sp3杂化
C. 氧原子参与形成离子键、配位键和氢键三种化学键
D. 胆矾中的水在不同温度下会分步失去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol某气态链烃充分燃烧可以生成7.2克水。请据此回答以下问题:
(1)通过计算确定该烃的分子式可能为_____、______(可不填满)。
(2)若经测定该烃存在支链,则该烃的结构简式为________,其同分异构体有多种,写出属同类烃的所有同分异构体的结构简式并命名(可不填满):
结构简式:________名称:________;
结构简式:________名称:________;
结构简式:________名称:________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
① C2H2(g) +![]() O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
O2(g) = 2CO2(g)+H2O(l) ΔH1=-1301.0 kJmol-1
② C(s)+ O2(g) = CO2(g) △H2=-393.5 kJmol-1
③ H2(g)+![]() O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
O2(g) = H2O(l) △H3 = -285.8 kJ·mol-1
则反应④ 2C(s)+ H2(g) = C2H2(g)的△H为( )
A.+228.2 kJ·mol-1B.-228.2 kJ·mol-1
C.+1301.0 kJ·mol-1D.+621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为![]() ,B原子L层的电子总数是K层的3倍;0.1 mol C单质从酸中置换出2.24 L氢气(标准状况),同时它变成Ne原子的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
,B原子L层的电子总数是K层的3倍;0.1 mol C单质从酸中置换出2.24 L氢气(标准状况),同时它变成Ne原子的电子层结构;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A______、B______、C______、D______;
(2)D元素在周期表中第______周期第______族;
(3)用电子式表示A的气态氢化物的形成过程_______________________;
(4)A和B的单质充分反应生成的化合物的结构式是__________________;
(5)四种元素中,______的最高价氧化物的水化物既能溶于酸,又能溶于碱,溶于NaOH溶液的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。
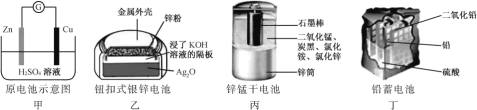
下列说法不正确的是( )
A. 甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 乙:正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C. 丙:锌筒作负极,发生氧化反应,锌筒会变薄
D. 丁:电池放电过程中,硫酸浓度不断减少。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g) ![]() 2C(g)+D(g) 已达平衡状态的是
2C(g)+D(g) 已达平衡状态的是
A.混合气体的压强B.混合气体的密度
C.B和C的物质的量浓度相等D.气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列物质中是同系物的有________;互为同分异构体的有____________;互为同素异形体的有________;互为同位素的有________;
(1)液氯(2)氯气(3)白磷(4)红磷(5)D(6)T(7)![]() (8)
(8)![]() (9)CH2=CH-CH3 (10)
(9)CH2=CH-CH3 (10)![]() (11)2,2—二甲基丁烷
(11)2,2—二甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
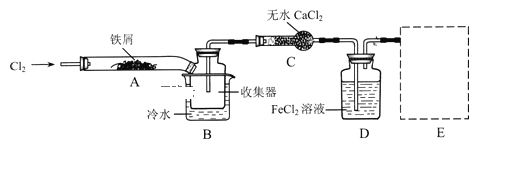
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为 _______________________
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是 ________________________
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) _________________________
(4)装置B中冷水浴的作用为;_________装置C的名称为 ______________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:__________________________
(5)在虚线框中尾气吸收装置E所用试剂为____________________________
(6)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品。
已知:金属离子的起始浓度为0.1mol·L-1
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:______________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com