
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系,下列有关物质的推断错误的是

A.若甲为C,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH溶液,则丁可能是CO2
科目:高中化学 来源: 题型:
【题目】有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如图:
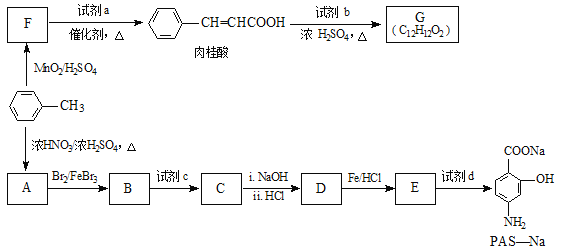
已知:
①![]()
②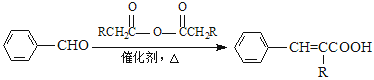 (R=—CH3或—H)
(R=—CH3或—H)
③![]()
回答下列问题:
(1)![]() 生成A的反应类型是___。
生成A的反应类型是___。
(2)F中含氧官能团的名称是___,试剂a的结构简式为___。
(3)写出由A生成B的化学方程式:___。
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:___。
(5)当试剂d过量时,可以选用的试剂d是___(填字母序号)。
a.NaHCO3 b.NaOH c.Na2CO3
(6)肉桂酸有多种同分异构体,写出符合下列条件的任意一种的结构简式___。
a.苯环上有三个取代基;
b.能发生银镜反应,且1mol该有机物最多生成4molAg;
c.苯环上有两种不同化学环境氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程的能量变化符合下图所示的是

A. 酸碱中和反应
B. CH4在O2中燃烧
C. NH4Cl晶体与Ba(OH)28H2O晶体混合搅拌
D. CaO溶于水生成Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学腐蚀及防护的研究装置如图所示,下列有关说法不正确的是

A.若a、b用导线相连,石墨电极上有气泡产生
B.若a、b不用导线相连,c处比d处更易产生铁锈
C.若a、b用导线相连,铁片主要发生吸氧腐蚀
D.若a、b分别连接电源的正、负极,将加快铁片的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
(1)蓄电池是一种可反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应如下:NiO2+Fe+2H2O![]() Fe(OH2+Ni(OH)2。
Fe(OH2+Ni(OH)2。
①此蓄电池在充电时,电池负极应与外加电源的___极连接,电极反应式为____。
②放电时生成Ni(OH)2的一极,在充电时发生___(填“氧化”或还原”)反应。
(2)按如图所示装置进行下列不同的操作。
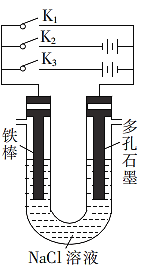
①K1、K2、K3中只关闭一个,则铁的腐蚀速率最快的是只闭合___(填“K1”“K2”或“K3”,下同)时;为减缓铁的腐蚀,应只__闭合,该防护法称为___
②只闭合K1,当铁棒质量减少5.6g时,石墨电极消耗的气体体积为_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1100℃时,在体积为5L的密闭容器中,发生可逆反应:Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)并达到平衡,请完成下列各题:
Na2S(s)+4H2O(g)并达到平衡,请完成下列各题:
(1)上述反应中涉及的非金属元素原子的半径从大到小的顺序为_____________,非金属性最强的元素原子的电子排布式_________________,其电子的自旋方向共有________种。
(2)该反应中O、S属于同主族元素,比较它们的单质的氧化性_____________________(用化学方程式表示),写出Na2O的电子式______,比较Na2O和Na2S的熔点高低:Na2O___Na2S。
(3)上述平衡的平衡常数表达式K=______________________。降低温度,K值减小,则正反应为_______(填“吸热”或“放热”)反应。
(4)能判断反应达到平衡状态的依据是_____________(填序号)。
A.混合气体的压强不变 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.各气体的浓度相等
(5)若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%,V(H2)=__________________。平衡后,向容器中充入1molH2,平衡向_________________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,H2的体积百分含量_____________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫沙朵林F是一种镇痛药,可通过木聚糖A按以下路线合成:

(1)有机物B中官能团的名称为____________________。有机物C中的碳碳双键如何检验____________________。
(2)写出同时满足下列条件的E的一种同分异构体的结构简式__________________________。
Ⅰ.存在四种不同化学环境的氢原子;
Ⅱ.能发生银镜反应和水解反应;
Ⅲ.能与FeCl3溶液发生显色反应。
(3)已知E+X→F为加成反应,写出该反应的化学方程式______________________________。
(4)已知:![]()
![]()
![]() 。化合物
。化合物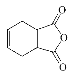 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以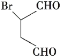 和
和![]() 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。_____________
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。_____________
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煅烧黄铁矿(主要成分为FeS2)所得的矿渣中含Fe2O3、SiO2、Al2O3、MgO等.用该矿渣可制备铁红(Fe2O3).完成下列填空:
(1)煅烧黄铁矿的化学方程式____,反应过程中被氧化的元素____.
(2)矿渣中属于两性氧化物的是___,写出Fe2O3与稀硫酸反应的离子方程式__.
(3)Al(OH)3的碱性比Mg(OH)2的碱性___(选填“强”或“弱”);铝原子最外层电子排布式为____.
(4)SiO2的熔点___ Fe2O3的熔点(填“大于”或“小于”),原因是__.
(5)已知矿渣质量为w kg,若铁红制备过程中,铁元素损耗25%,最终得到铁红的质量为m kg,则原来矿渣中铁元素质量分数为______(用表达式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.![]() 和CO的混合物共
和CO的混合物共![]() ,其中碳原子的数目为NA
,其中碳原子的数目为NA
B.![]() 重水
重水![]() 分子中含有的中子数为0.8NA
分子中含有的中子数为0.8NA
C.![]() 放入过量的98%浓
放入过量的98%浓![]() 中,转移电子数为3NA
中,转移电子数为3NA
D.![]()
![]() 的NaCl溶液中微粒数大于0.5NA
的NaCl溶液中微粒数大于0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com