
【题目】Ⅰ.现有①甲烷、②乙烯、③苯、④乙酸、⑤甘氨酸(氨基乙酸)5种有机物,请用序号或按题中要求作答:
(1)分子中所有原子都共平面的是__________________。
(2)含氢量最高的是_______,含碳量最高的是________。
(3)完全燃烧后生成的CO2和水的物质的量之比为1∶1的是__________。
(4)其中含有两种不同官能团的有机物是_____,其结构简式为________________,官能团的名称分别为__________和__________。
Ⅱ.下图表示4个碳原子相互结合的几种方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
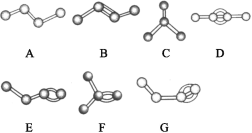
(5)图中属于烷烃的是______(填字母)。
(6)上图中A与________、B与________、D与_____互为同分异构体(填字母)。
【答案】 ②、③ ① ③ ②、④ ⑤ H2NCH2COOH 羧基(或氨基) 氨基(或羧基) A、C C EF G
【解析】
Ⅰ.(1)甲烷、乙酸和甘氨酸分子中均含有饱和碳原子,分子中所有原子不可能都共平面;乙烯和苯是平面形结构,分子中所有原子都共平面,答案选②③。
(2)根据有机物分子式可判断含氢量最高的是甲烷,答案选①;含碳量最高的是苯,答案选③。
(3)完全燃烧后生成的CO2和水的物质的量之比为1∶1,这说明有机物分子中碳氢原子的个数之比是1∶2,符合条件的是乙烯和乙酸,答案选②④。
(5)甲烷和苯不含有官能团,乙烯含有碳碳双键,乙酸含有羧基,甘氨酸含有氨基和羧基,则含有两种不同官能团的有机物是甘氨酸,其结构简式为H2NCH2COOH。
Ⅱ.根据有机物的结构模型可知A是正丁烷,B是2-丁烯,C是异丁烷,D是2-丁炔,E是1-丁烯,F是2-甲基-1-丙烯,G是1-丁炔。则
(5)图中属于烷烃的是正丁烷和异丁烷,答案选AC。
(6)分子式相同,结构不同的化合物互为同分异构体,则上图中A与C、B与EF、D与G互为同分异构体。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |

下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中我们常用到铝制餐具。铝在空气中稳定存在的原因是( )
A.铝能产生铝热反应B.铝的化学性质不活泼
C.常温下铝不能与氧气反应D.铝表面能形成致密的氧化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“CH3COOK”的分类不正确的是
A.化合物B.氧化物C.有机物D.钾盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡: H2O![]() H++ OH-ΔH > 0 ,下列叙述正确的是
H++ OH-ΔH > 0 ,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D. 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能量是国民经济发展的重要基础,天然气是我国目前使用的主要能源。
(1)已知
化学键 | C-H | C=O | O=O | H-O |
E/(KJ/mol) | a | b | c | d |
CH4(g)+2O2(g)=CO2(g)+2H2O(g)的焓变ΔH=______kJ/mol。
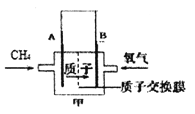
(2)燃料电池具有高的发电效率,因而受到重视。下图甲为甲烷燃料电池(电解质溶液为硫酸)该电池的正极反应为_________。
(3)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D均为铂电极,
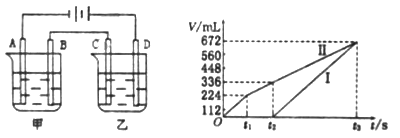
I.甲槽中有200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如上图所示(气体体积已换算成标准状况下的体积),(电解前后溶液的体积变化关系忽略不计)
①原混合溶液中NaCl的物质的量浓度__________mol/L。
②t2时所得溶液的pH=________。
Ⅱ.乙槽中为足量的AgNO3溶液。则阳极反应为__________。t3时电解结束,为了使溶液恢复原样,则可以在反应后的溶液中加入______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O===2LiOH+H2↑。电池工作时,下列说法错误的是( )

A. 金属锂作负极
B. 电子从锂电极经导线流向镍电极
C. 可将电能转化为化学能
D. 海水作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用新方案和新工艺处理废旧铅酸蓄电池,可以达到节能减排、防治污染和资源循环利用的目的。一种处理铅酸蓄电池的流程如下:

已知:Ksp(PbSO4)=1.6×10-8)和Ksp(PbCO3)=7.4×10-14
(1)写出铅酸蓄电池放电时的总反应____________________________________________;
(2)废旧电池的预处理时需要将电池放电完全,目的是____________________________;
(3)写出铅膏脱硫时的离子方程式____________________________________________。
(4)传统的铅蓄电池的处理工艺是将电池破碎后,洗涤,干燥,直接送入回转炉熔炼。而该工艺使用纯碱脱硫的显著优点是________________________________________。
(5)从Na2SO4溶液中结晶出Na2SO4·10H2O晶体的方法是蒸发浓缩、___________、过滤洗涤,洗涤时用乙醇洗涤晶体,用乙醇而不用水洗涤的原因是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com