
【题目】25℃时,将浓度均为0.1mol·L-1、体积分别为Va和Vb的HX溶液与NH3·H2O溶液不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法正确的是( )
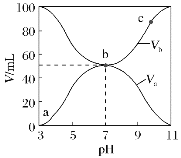
A.Ka(HX)的值与Kb(NH3·H2O)的值相等
B.b点,c(NH4+)+c(HX)=0.05mol·L-1
C.a→c点过程中,一定有c(NH4+)>c(X-)>c(H+)>c(OH-)
D.a、b、c三点,c点时水电离出的c(H+)最大
【答案】AB
【解析】
根据图式可知,酸溶液的pH=3,则c(H+)<0.1mol/L,说明HA是弱酸;碱溶液的pH=11,c(OH)<0.1mol/L,则NH3H2O是弱碱;
A.酸碱恰好完全反应时溶液的pH=7,溶液呈中性,说明HA电离程度和NH3H2O电离程度相同,则Ka(HX)的值与Kb(NH3H2O)的值相等,故A正确;
B.b点,溶液显中性,HX和NH3·H2O的初始浓度为0.1mol·L-1,等体积混合后, c(H+)=c(OH),电荷守恒为c(OH)+c(X-)=c(NH4+)+c(H+),则c(NH4+)=c(X-),HX溶液的物料守恒为:c(X-)+c(HX)=0.05mol·L-1,故c(NH4+)+c(HX)=0.05mol·L-1,故B正确;
C.a→c点过程中,随着氨水的加入,溶液的由酸性变为中性,再变为碱性,c点时,c(H+)<c(OH-) ,故C错误;
D.a、b、c三点,c点显碱性,a点显酸性,对水的电离都有抑制作用,b点的溶液显中性,没有抑制水的电离,故b点时水电离出的c(H+)最大,故D错误;
答案选AB。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)1735年瑞典化学家布兰特(G·Brands)制出金属钴。钴的矿物或钴的化合物一直用作陶瓷、玻璃、珐琅的釉料。到20世纪,钴及其合金在电机、机械、化工、航空和航天等工业部门得到广泛的应用,并成为一种重要的战略金属。所以钴及其化合物具有重要作用,回答下列问题:
(1)基态Co原子的电子排布式为___________。
(2)[Co(NH3)5H2O]Cl3是一种砖红色的晶体,可通过CoCl2、NH4Cl、浓氨水、H2O2制得。
①Co、N、0原子的第一电离能由大到小的顺序是__________。
②[Co(NH3)5H2O]Cl3中Co元素化合价为____,其配位原子为_____;1mol该晶体中含有____molσ键。
③H2O2中O原子的杂化轨道类型是______,H2O2能与水互溶,除都是极性分子外,还因为____。
④NH3、NF3的空间构型都相同,但Co3+易与NH3形成配离子,而NF3不能。原因是________。
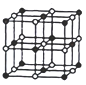
(3)CoO晶胞如图,已知Co原子半径为apm,O原子半径为bpm,则等距最近的所有O原子围成的空间形状为_____;该晶胞中原子的空间利用率为__________(用含a、b的计算式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图形象地表示氯化钠的形成过程。下列相关的叙述中不正确的是( )

A.钠原子易失去一个原子,氯原子易得到一个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用形成![]() 后,其结构的稳定性增强
后,其结构的稳定性增强
D.氯化钠中微粒之间形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.1mol/L HCl溶液中由水电离出的H+的浓度为_______;
(2)若向氨水中加入少量硫酸铵固体,此时溶液中![]() 将_______;(填“增大”、“减小”或“不变”)
将_______;(填“增大”、“减小”或“不变”)
(3)25℃时,向AgNO3溶液中加入BaCl2溶液和KBr溶液,当两种沉淀共存时,![]() =____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
=____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
(4)用离子方程式表示NH4F不能用玻璃试剂瓶装的原因________;
(5)25℃时,有下列四种溶液:A. 0.1mol/L CH3COONH4溶液 B. 0.1mol/L CH3COOH溶液 C.0.1mol/L CH3COONa溶液 D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液(混合液呈酸性)
① 已知A溶液呈中性,试推断(NH4)2CO3溶液呈______性(填“酸”或“碱”或“中”);
② D溶液中除H2O外所有分子、离子浓度由大到小的顺序为________;
③ 上述四种溶液中水的电离程度由小到大的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
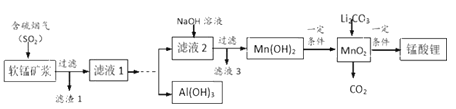
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)为提高含硫烟气中SO2的吸收率,可以采取的措施_____________(举一例)。
(2)滤液1中所含金属阳离子有Mn2+、_____________(填离子符号)。
(3)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是_________________;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式___________;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_________________。
(4)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中________________。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为原料,经过一系列反应可以制得酯F(C5H8O4)。B结构中有甲基,1mol B 可以与2mol Na和1mol NaOH反应。
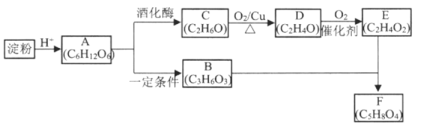
请回答:
(1)E中官能团名称是________。
(2)C→D的反应类型是___________。
(3)D→E的化学反应方程式是_____________。
(4)F的结构简式是____________。
(5)下列说法不正确的是__________。
A 由A生成C时可以产生一种无色无味气体
B 可以用新制Cu(OH)2悬浊液鉴别C、D、E (必要时可以加热)
C 相同物质的量的B、D耗氧量相同
D 1mol F与足量钠反应,消耗钠2mol
(6)检验淀粉在酸性条件下水解产物A (C6H12O6)的操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃、1.01x105Pa时,将1L丙烷与若干升O2混合点燃充分燃烧后,恢复至原温度、压强,测得气体体积为aL,通过碱石灰后气体体积变为bL。
(1)若a-b=7, 则bL气体中一定含有____。
(2)若a-b=5,则混合前O2体积是______,点燃前混合气体的平均摩尔质量是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性而研发的新型可充放电电池,其反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
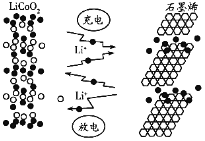
A. 充电时,![]() 嵌入
嵌入![]() 中
中
B. 放电时,![]() 极发生的电极反应为
极发生的电极反应为![]()
C. 放电时负极反应为:![]()
D. 充电时,若转移![]() ,石墨烯电极增重7g
,石墨烯电极增重7g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com