

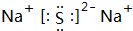 ,故答案为:
,故答案为: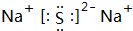 ;
;

科目:高中化学 来源: 题型:
| A、2.7 g金属铝变为铝离子时失去的电子数为0.1NA |
| B、任何条件下,16gCH4与18 g H2O所含有电子数均为10NA |
| C、1 mol HCl气体中的粒子数与0.5 mol/L盐酸中溶质粒子数相等 |
| D、22.4 L的CO气体与1 mol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、空气、天然气、苛性钾、石灰石 |
| B、液氯、氯水、硫酸钠、乙醇 |
| C、盐酸、水煤气、纯碱、液氯 |
| D、盐酸、空气、氯酸钾、金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
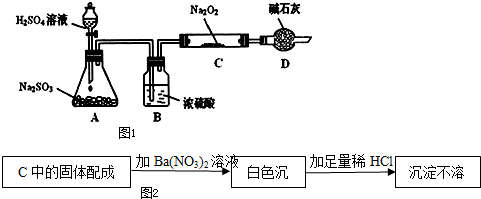
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A的生成速率与C的分解速率相等 |
| B、单位时间生成2nmolA,同时生成3nmolB |
| C、A、B、C的浓度不再发生变化 |
| D、A、B、C的分子数之比为2:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com