
����Ŀ����֪X��Y��Z��W����Ԫ�طֱ���Ԫ�����ڱ����������������ڵ�Ԫ�أ���ԭ��������������X��Wͬ���壬Y��ZΪͬ���ڵ�����Ԫ�أ�Wԭ�ӵ�����������Y��Zԭ������������֮�ͣ�Y��X�γɵķ�������3�����ۼ���Zԭ�������������Ǵ�����������3�������ƶϣ�
��1��������Ԫ���У����4��10���ӵ����ӵ���ʽ��
��2��X��Z�ɷֱ��γ�10���Ӻ�18���ӵķ��ӣ�д����18���ӷ���ת����10���ӷ��ӵĻ�ѧ����ʽ��
��3����X��Y��Z���γɵij������ӻ���������д��ѧʽ�����û�������W������������Ӧ��ˮ�����Ũ��Һ����ʱ��Ӧ�����ӷ���ʽΪ��
X��W�γɵĻ�������ˮ��Ӧʱ�����ӷ���ʽΪ �� ˮ���������������ԭ��������
��4���õ���ʽ��ʾW��Z�γ�W2Z������Ĺ��̣� ��
���𰸡�
��1��![]()
��2��2H2O2 ![]() 2H2O+O2��
2H2O+O2��
��3��NH4NO3��NH4++OH�� ![]() NH3��+H2O��NaH+H2O=Na++OH��+H2����������
NH3��+H2O��NaH+H2O=Na++OH��+H2����������
��4��![]()
���������⣺X��Y��Z��W����Ԫ�طֱ���Ԫ�����ڱ����������������ڵ�Ԫ�أ���ԭ����������������XΪHԪ�أ�Zԭ�������������Ǵ�����������3����ԭ��ֻ����2�����Ӳ㣬����������Ϊ6����ZΪOԪ�أ�Y��ZΪͬ���ڵ�����Ԫ�أ���YΪNԪ�أ�Y��X�γɵ�NH3��������3�����ۼ���X��Wͬ���壬��Wԭ�ӵ�����������Y��Zԭ������������֮�ͣ���WΪNa����1��������Ԫ���У����4��10���ӵ�����ΪH3O+ �� ����ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����2��H��O�ɷֱ��γ�10���Ӻ�18���ӵķ��ӣ�ΪH2O2��H2O�����������ڶ������������������·ֽ�Ϊˮ����������Ӧ����ʽΪ��2H2O2
����2��H��O�ɷֱ��γ�10���Ӻ�18���ӵķ��ӣ�ΪH2O2��H2O�����������ڶ������������������·ֽ�Ϊˮ����������Ӧ����ʽΪ��2H2O2 ![]() 2H2O+O2�������Դ��ǣ�2H2O2
2H2O+O2�������Դ��ǣ�2H2O2 ![]() 2H2O+O2������3����X��Y��Z���γɵij������ӻ�������NH4NO3 �� W������������ˮ����ΪNaOH�����߷�Ӧ�����ӷ���ʽΪ��NH4++OH��
2H2O+O2������3����X��Y��Z���γɵij������ӻ�������NH4NO3 �� W������������ˮ����ΪNaOH�����߷�Ӧ�����ӷ���ʽΪ��NH4++OH�� ![]() NH3��+H2O��X��W�γɵĻ�������NaH���⻯�ƺ�ˮ��Ӧ�����������ƺ���������Ӧ���ӷ���ʽΪ��NaH+H2O=Na++OH��+H2�����÷�Ӧ��ˮ�õ����������������Դ��ǣ�NH4NO3��NH4++OH��
NH3��+H2O��X��W�γɵĻ�������NaH���⻯�ƺ�ˮ��Ӧ�����������ƺ���������Ӧ���ӷ���ʽΪ��NaH+H2O=Na++OH��+H2�����÷�Ӧ��ˮ�õ����������������Դ��ǣ�NH4NO3��NH4++OH�� ![]() NH3��+H2O��NaH+H2O=Na++OH��+H2��������������4���õ���ʽ��ʾW��Z�γ�Na2O������Ĺ��̣�
NH3��+H2O��NaH+H2O=Na++OH��+H2��������������4���õ���ʽ��ʾW��Z�γ�Na2O������Ĺ��̣� ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Լ���������������ͭ����Һ����Ũ�������������Һ���ܵ�ˮ��Ϊ�˼��������ǡ����ۡ�ʳ�Ρ���������ƿ��ɫ��Һ��ѡ����ʵ��Լ�����ȷ˳����(����)
A. �٢ڢۢ� B. �ܢ٢ڢ� C. �٢ܢڢ� D. �٢ܢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ЧӦ�������ǣ� ��
A. ��������B. ������̼C. ����D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�����ڻ�ѧ�仯����
A. ʯ�ͷ��� B. ú���� C. ʯ���ѽ� D. ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��½�3mol CO2��2mol H2�����2L���ܱ������У��������·�Ӧ��CO2��g��+H2��g��CO��g��+H2O��g��
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=_____��
��2����֪��700��ʱ���÷�Ӧ��ƽ�ⳣ��K1=0.6������¶��·�ӦCO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ��K2=_____����Ӧ![]() CO2��g��+
CO2��g��+![]() H2��g��
H2��g��![]() CO��g��+
CO��g��+![]() H2O��g����ƽ�ⳣ��K3=_____��
H2O��g����ƽ�ⳣ��K3=_____��
��3����֪��1 000��ʱ���÷�Ӧ��ƽ�ⳣ��K4Ϊ1.0����÷�ӦΪ_____��Ӧ������ȡ����ȡ�����
��4�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������_____��
A��������ѹǿ����
B��c��CO2��=c��CO��
C������a mol CO2��ͬʱ����a mol H2
D����������ƽ����Է�����������
��5����1 000���£�ijʱ��CO2�����ʵ���Ϊ2.0mol�����ʱv������_____v���棩�����������=����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������,��Ϊͬ���칹�����(����)
A. ���ۺ������� B. ���Ǻ���ά�� C. ���ۺ���ά�� D. ���Ǻ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ���ָ������ϵͳѧϰ��ѧ����Ҫ���ߡ��±���Ԫ�����ڱ���һ���֣�
C | N | O | F |
Si | P | S | Cl |
Br | |||
I |
��1��Ԫ�����ڱ���ÿ��Ԫ�صľ�����Ϣ��ͼ��ʾ�����п��Ի�÷�Ԫ�ص��й���Ϣ�У�����д��1�㣩_________________________________________��
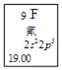
��2����ԭ�ӽṹ�Ƕȷ�����C��N��O��F����Ԫ�ش���ͬһ�У����������ǵ�______��ͬ��N��P����ͬһ�У���Ϊ���ǵ�________��ͬ�����Ƕ�λ��Ԫ�����ڱ��ĵ�______�塣
��3��ͨ��Ԫ�����ڱ������ǿ���֪����
�ٵ�Ԫ�ص���ͻ��ϼ�Ϊ___________������̬�⻯��ĵ���ʽΪ_________________��
��ԭ�Ӱ뾶��r(P)_________r(S)������������������������������
�����ϱ�����Ԫ�ص�����������Ӧˮ������������ǿ����_________��д��ѧʽ��.
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com