
【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗名“大苏打”,又称“海波”.已知Na2S2O35H2O是无色透明晶体,易溶于水,不溶于乙醇.它受热、遇酸易分解,在空气中易被氧化.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O35H2O).反应原理为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2 . 
(1)(图1)制备Na2S2O3
①仪器b的名称 , d中盛放的试剂是 .
②b中制备SO2 , 反应的化学方程式 .
③反应开始后,要控制SO2生成速率,可以采取的措施有(写出一条即可).
(2)分离Na2S2O3并测定含量(图2)
(I)为了减少产品损失,操作①时需 . 操作②是过滤、洗涤、干燥,其中洗涤操作时用做洗涤剂.干燥操作时(装置如图3所示),通入H2的目的是 .
(II)制得的粗晶体中往往含有少量杂质.为了测定粗产品中Na2S2O35H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应).称取1.50g粗产品溶于水,用0.20molL﹣1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中S2O32﹣全部被氧化时,消耗高锰酸钾溶液体积40.00mL.(5S2O32﹣+8MnO4﹣+14H+═8Mn2++10SO42﹣+7H2O)
①KMnO4溶液置于(填“酸式”或“碱式”)滴定管中.
②若 , 则达到滴定终点.
③产品中Na2S2O35H2O的质量分数为(保留小数点后一位).
【答案】
(1)蒸馏烧瓶;氢氧化钠溶液;Na2SO3+H2SO4(浓) ![]() ?Na2SO4+SO2↑+H2O;控制反应温度或调节酸的滴加速度等
?Na2SO4+SO2↑+H2O;控制反应温度或调节酸的滴加速度等
(2)趁热过滤;乙醇;排出空气,防止硫代硫酸钠被氧化;酸式;滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色;82.7%
【解析】解:(1)①由仪器结构可知,仪器b为蒸馏烧瓶;蒸馏烧瓶中浓硫酸与亚硫酸钠反应制备SO2 , c装置中制备Na2S2O3 , d装置吸收多余的二氧化硫,防止污染空气,应用氢氧化钠溶液吸收,所以答案是:蒸馏烧瓶;氢氧化钠溶液;
②b中制备SO2 , 浓硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4(浓) ![]() Na2SO4+SO2↑+H2O,
Na2SO4+SO2↑+H2O,
所以答案是:Na2SO3+H2SO4(浓) ![]() Na2SO4+SO2↑+H2O;
Na2SO4+SO2↑+H2O;
③反应开始后,要控制SO2生成速率,可以采取的措施有:控制反应温度或调节酸的滴加速度等,
所以答案是:控制反应温度或调节酸的滴加速度等;
控制SO2生成速率;(2)(I)需要趁热过滤,防止硫代硫酸钠晶体析出;
硫酸硫酸钠易溶于水,不溶于乙醇,为减少溶解单质的损失,应用乙醇洗涤;
用氢气排出空气,防止硫代硫酸钠被氧化,
所以答案是:趁热过滤;乙醇;排出空气,防止硫代硫酸钠被氧化;(II)①KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管中,
所以答案是:酸式;
②Na2S2O3反应完毕,滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色,说明反应到达终点,
所以答案是:滴入最后一滴高锰酸钾标准液后,溶液恰好由无色变浅紫红色,且半分钟不褪色;
③由方程式可知n(Na2S2O35H2O)=n(S2O32﹣)= ![]() n(KMnO4)=
n(KMnO4)= ![]() ×0.04L×0.2mol/L=0.005mol,则m(Na2S2O35H2O)=0.005mol×248g/mol=1.24g,则Na2S2O35H2O在产品中的质量分数为
×0.04L×0.2mol/L=0.005mol,则m(Na2S2O35H2O)=0.005mol×248g/mol=1.24g,则Na2S2O35H2O在产品中的质量分数为 ![]() ×100%=82.7%,
×100%=82.7%,
所以答案是:82.7%.


科目:高中化学 来源: 题型:
【题目】如下图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化.下列说法正确的是( ) 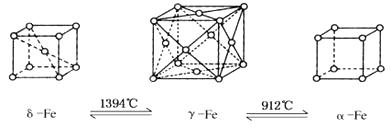
A.γFe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.αFe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.将铁加热到1 500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.三种同素异形体的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用物理方法从植物体中提取,或是用化学方法合成药用化学物质,治疗病症,挽救性命,一直是科学家们致力研究的课题.请用化学知识分析“青蒿素”、“华法林”两种药物的结构及合成过程.
(1)2015年诺贝尔医学奖授予中国女药学家屠呦呦.“因为发现青蒿素,一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.” 
下列关于青蒿素和双氢青蒿素(结构如图1所示)的说法错误的是 .
A.青蒿素分子中含有过氧键、酯基和醚键
B.青蒿素的分子式为C15H22O5
C.由双氢青蒿素转化为青蒿素的反应属氧化反应
D.双氢青蒿素分子中有2个六元环和2个七元环
(2)华法林是一种治疗心脑血管疾病的药物,其合成路径如图2(部分反应条件略去). 
已知:①![]()
②
(I)A属于芳香烃,名称是;
(II)C生成D的反应类型是; E与N合成华法林的反应类型是 .
(III)B→C的转化过程中的化学反应方程式为;
(IV)E的结构简式是 . L→M的转化中,会产生少量链状高分子聚合物,该聚合物的结构简式为 .
(V)K有多种同分异构体,满足下列条件的K的同分异构体还有种.
①属于芳香族化合物 ②遇到FeCl3显紫色 ③可发生水解反应.
写出其中满足核磁共振氢谱图显示峰值比为1:2:2:2:1的同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法正确的是
A. 氢氧化钙可用来治疗胃酸过多B. 活性炭可用作水处理时的杀菌剂
C. 铝制容器可用来储运浓硝酸D. 氧化钠可用作潜水艇里氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项正确的是( )
A.汽车催化转化器中尾气处理反应的化学方程式为CO+NO ![]() C+NO2
C+NO2
B.铁红溶于足量氢碘酸的离子方程式为Fe2O3+6H+═2Fe3++3H2O
C.加入铝粉能产生氢气的溶液中可能存在大量的:K+、Ba2+、AlO2﹣、Cl﹣
D.pH=0的溶液中可能存在大量的:Na+、Fe2+、SO42﹣、ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是( )
A. 活化分子之间的碰撞不一定都是有效碰撞
B. 升高温度,可使单位体积内活化分子增多,反应速率加快
C. 对于有气体参加的反应增大压强,可使单位体积内活化分子百分数增加,反应速率加快
D. 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】霍奇金淋巴瘤是青年人中最常见的恶性肿瘤之一.丙卡巴肼是治疗该病的有效药物,其主要合成工艺路线如下: 
(1)A的名称为 , 丙卡巴肼的分子式为 .
(2)有机物B生成C的化学方程式为(注明条件)
(3)下列分析合理的是(填字母).
a.有机物D可发生水解反应
b.有机物E中含有酯基
c.有机物F具有酸性
d.有机物G中所有碳原子一定在同一平面上
(4)F生成G过程中用到的HCOOH具有独特的性质,写出HCOOH与足量新制的氢氧化铜反应的化学方程式: .
(5)有机物B有多种同分异构体,写出符合下列条件的有机物B的结构简式: .
a.能发生银镜反应
b.苯环上的一取代物有两种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2 gCu投入到一定浓度的HNO3溶液中,恰好完全反应,产生NO2和NO的混合气体共 0.08 mol。则原溶液中HNO3的物质的量为( )
A.0.34 molB.0.38 molC.0.28 molD.0.18 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com