
【题目】太阳能电池板面对太阳时,一部分电能直接供给“天宫一号”,一部分电能则储存在电池里,供背离太阳时使用。“天宫一号”使用的是镍氢电池,电解质溶液显碱性。其反应方程式为: LaNi5+Ni(OH)2![]() LaNi5H+NiOOH。下列有关说法不正确的是
LaNi5H+NiOOH。下列有关说法不正确的是
A. 放电时镍被还原 B. 放电时负极LaNi5H+OH——e—=LaNi5+H2O
C. 充电时OH—向阴极移动 D. 充电时每消耗lmol Ni(OH)2转移lmol电子
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),这种元素的原子结构示意图为___________。
(2)④与⑤两种元素相比较,原子半径较大的是_______(填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是______(填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是_______(填化学式),具有两性的化合物是_______(填化学式)。
(3)③与⑥元素的氢化物的稳定性_________ 大于 __________(填化学式)。
(4)元素④和元素⑦形成化合物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
(5)⑦的氢化物的电子式为_____________,化学键类型是_______,属于______化合物(填“离子”或者“共价”)。请用电子式表示该化合物的形成过程:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生在做同主族元素性质递变规律的实验时,自己设计了一套实验方案,并记录了有关的实验现象。现在请你帮助该学生整理并完成实验报告。
(1)实验目的:探究同一主族元素性质的递变规律。
(2)实验用品:
仪器:试管、胶头滴管
药品:氯水、溴水、溴化钠溶液、碘化钠溶液、四氯化碳。
(3)实验内容(在下表横线中填写相关内容):
序号 | 实验方案 | 实验现象 |
① | 向盛有少量溴化钠溶液的试管中滴加少量新制的氯水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈__色 |
② | 向盛有少量碘化钾溶液的试管中滴加少量新制溴水,振荡,再注入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈__色 |
(4)实验结论:____________________。
(5)问题和讨论:
①上述两个实验中发生的反应的离子方程式分别为_________、________。
②由于氟过于活泼,所以很难设计出一个简单的实验来验证其氧化性的强弱。试列举两项事实说明氟的非金属性比氯强:_______、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 在稀溶液中,1 mol酸和1 mol碱完全反应所放出的热量,叫做中和热
B. 在101 kPa时,1 mol物质燃烧时所放出的热量叫做该物质的燃烧热
C. 热化学方程式中,各物质前的化学计量数不表示分子个数
D. 如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为铜锌原电池的装置图,根据装置图填写空白.
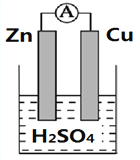
(1)将________转化为________的装置叫做原电池
(2)Zn极上的电极反应式为:_____________________________________。
(3)Cu极发生的是_____________反应(“氧化”或“还原”)。铜片上观察到的现象为___________________;
(4)溶液中H+的流动方向为__________________;
(5)若烧杯中溶液为AgNO3溶液,则负极为________(填Zn或Cu),总反应方程式为________________________________。
(6)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:A、B两个电极均由多孔的碳块组成。该电池的正极反应物为:___________。
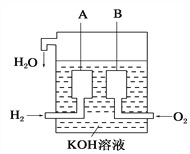
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:
(1)A在元素周期表中的位置是_______________;A与E形成的化合物的电子式是 ________。
(2)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是_________。
(3)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是______。
(4) F的单质与C、D形成的相对分子质量为160的化合物在一定条件下反应的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量的浓度和混合液的pH如下表所示:
实验编号 | HA的物质的量浓度(mol·L-1) | NaOH的物质的量浓度(mol·L-1) | 混合后溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸? 。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是 。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
Ⅱ.某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB-![]() H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。
已知:2NH3(g) ![]() N2 (g)+3H2(g) △H= 92.4 kJ·mol-1
N2 (g)+3H2(g) △H= 92.4 kJ·mol-1
2H2 (g)+O2 (g)=2H2O(g) △H= - 483.6 kJ·mol-1
NH3(l) ![]() NH3 (g) △H= 23.4 kJ·mol-1
NH3 (g) △H= 23.4 kJ·mol-1
(1) 4NH3(l)+3O2 (g)![]() 2N2(g)+6H2O(g) 的△H=______,该反应的平衡常数表达式为______。
2N2(g)+6H2O(g) 的△H=______,该反应的平衡常数表达式为______。
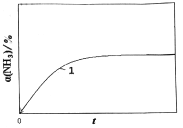
(2) 2NH3(g) ![]() N2(g)十3H2(g)能自发的条件是_________(填“高温”或“低温”);恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线1。如果保持其他条件不变,将反应温度提高到T2,请在图中再添加一条催化分解初始浓度也为c0的氨气过程中α(NH3)~t的总趋势曲线_________(标注2)。
N2(g)十3H2(g)能自发的条件是_________(填“高温”或“低温”);恒温(T1)恒容时,催化分解初始浓度为c0的氨气,得氨气的转化率α(NH3)随时间t变化的关系如图曲线1。如果保持其他条件不变,将反应温度提高到T2,请在图中再添加一条催化分解初始浓度也为c0的氨气过程中α(NH3)~t的总趋势曲线_________(标注2)。
(3)有研究表明,在温度大于70℃、催化剂及碱性溶液中,可通过电解法还原氮气得到氨气,写出阴极的电极反应式______________________。
(4) 25℃时,将amol/L的氨水与b mol/L盐酸等体积混合(体积变化忽略不计),反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国卫生部门制定的《关于宣传吸烟有毒与控制吸烟》的通知中规定:“中学生不准吸烟”。香烟燃烧产生的烟气中,有多种有害物质,其中尼古丁(C10H14N2)对人体危害最大,下列说法正确的是
A.尼古丁是由26个原子构成的物质
B.尼古丁中C、H、O 三种元素的质量比为10:14:2
C.尼古丁的相对分子质量是162g
D.尼古丁中氮元素的质量分数为17.3 %
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com