
【题目】实验是化学学科的一种重要学习手段,硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.(查阅资料)
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.(产品制备)实验装置如图所示(省略夹持装置):
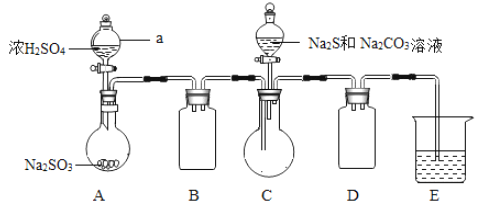
实验步骤:
(1)组装好仪器后,接下来应该进行的实验操作是______,仪器a的名称是______________;E中的试剂是____________(选填下列字母编号),作用是___________________。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)按图示加入试剂。
(3)已知Na2S2O3·5H2O的溶解度随温度升高显著增大,待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经______(填操作方法)、冷却结晶、过滤、洗涤、干燥,得到产品,过滤时用到的玻璃仪器有_______________。
Ⅲ.(探究与反思)
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,是否说明一定有Na2SO4,__(填“是”或“否”),过滤,向白色沉淀中加入足量稀盐酸,如果产品中含有Na2SO3和Na2SO4,则加入稀盐酸产生的现象是______;
(2)为减少装置C中生成Na2SO4的量,应该先打开______(填“A”或“C”)装置上的活塞。
(3)所得粗产品可以通过_________________方法提纯(填操作名称)。
【答案】检查装置气密性 分液漏斗 B 吸收二氧化硫尾气,防止污染环境 蒸发浓缩 漏斗、烧杯、玻璃棒 否 沉淀部分溶解,有刺激性气味的气体产生 A 重结晶
【解析】
Ⅱ.(1)SO2有毒,需要尾气处理,E装置是吸收SO2的,可用氢氧化钠溶液吸收;
(3)要从溶液中得到硫代硫酸钠晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到产品;
Ⅲ.(1)Na2SO3和Na2SO4和BaCl2溶液均可以产生白色沉淀,其中BaSO4难溶于酸,BaSO3会溶于酸且生成刺激性气味的气体SO2;
(2)先向A中烧瓶滴加浓硫酸,产生的气体先将装置中空气排尽,防止空气氧化亚硫酸盐;
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,可通过重结晶方法提纯。
Ⅱ.(1)组装好仪器后,接下来应该进行的实验操作是检查装置气密性,仪器a是分液漏斗。根据装置可知,A装置是制备SO2的,C装置是制备得Na2S2O3,B、D装置是防倒吸的,由于SO2有毒,需要尾气处理,因此E装置是吸收SO2的。
A. SO2不与稀H2SO4反应,无法吸收SO2,故A错误;
B.由于SO2是酸性氧化物,可以用氢氧化钠溶液吸收,即E中的试剂是氢氧化钠溶液,故B正确;
C. SO2不与饱和NaHSO3溶液反应,无法吸收SO2,故C错误;
答案选B。
E中作用是:吸收二氧化硫尾气,防止污染环境;
(3)由于Na2S2O3·5H2O是无色透明晶体,易溶于水,Na2S2O3·5H2O的溶解度随温度升高显著增大,因此要从溶液中得到硫代硫酸钠晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥、得到产品。过滤时用到的玻璃仪器有漏斗、烧杯、玻璃棒;
Ⅲ.(1)Na2SO3和Na2SO4和BaCl2溶液均可以产生白色沉淀,有白色沉淀生成,不能说明一定有Na2SO4,因此要进一步验证,则可以向白色沉淀中滴加稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4;
(2)由于亚硫酸盐易被氧化生成硫酸盐,而装置中含有空气,空气能氧化亚硫酸盐,所以为减少装置C中生成的Na2SO4的量,改进后的措施是先向A中烧瓶滴加浓硫酸,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液;
(3)由于Na2S2O3·5H2O的溶解度随温度升高显著增大,因此所得产品通过重结晶方法提纯。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】化合物H是一种除草剂,可由下列路线合成(部分反应条件略去):

(1)B和A具有相同的实验式,分子结构中含一个六元环,核磁共振氢谱显示只有一个峰,则B的结构简式为__________,A→B的反应类型是__________。
(2)C中含氧官能团的名称是__________;ClCH2COOH的名称(系统命名)是__________。
(3)D→E所需的试剂和条件是__________。
(4)F→G的化学方程式是___________________。
(5)I是E的一种同分异构体,具有下列结构特征:①苯环上只有一个取代基;②是某种天然高分子化合物水解的产物。I的结构简式是__________。
(6)设计由乙醇制备![]() 的合成路线__________(无机试剂任选)。
的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池(如图)工作时,下列叙述错误的是( )

A. 正极反应为:Cu2++2e–= Cu
B. 电池反应为:Zn+Cu2+=Zn2+ +Cu
C. 在外电路中,电子从负极流向正极
D. 盐桥中的K+移向ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)N位于周期表中第________周期________族。
(2)C、N、O三种元素的第一电离能由大到小的顺序为________________。
(3)Cu+的电子排布式为________________________,其在酸性溶液中不稳定,可发生歧化反应生成Cu 2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O________________________________________。
(4)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是________,乙醛分子中H﹣C﹣O的键角________乙醇分子中的H﹣C﹣O的键角(填“大于”、“等于”或“小于”)。
(5)[Cu(H2O)4]2+中的两个H2O被Cl-取代有两种不同的结构,则[Cu(H2O)4]2+的结构为________形。
(6)Cu3N的晶胞结构如图,N3﹣的配位数为________,Cu+半径为a pm,N3﹣半径为bpm,Cu3N的密度________________g/cm3。(阿伏加德罗为常数用NA表示)(1pm=10﹣10 cm)
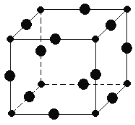
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的且操作正确的是

A. 用图a所示装置配制100mL0.100mol·L-1稀盐酸
B. 用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体
C. 用图c所示装置制取少量CO2气体
D. 用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为_______________。
(2)反应前A的物质的量浓度是_______________。
(3)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度_______________;②增大A的浓度_______________;③增大压强_______________。
(4)下列叙述能说明该反应已达到化学平衡状态的是_______________(填标号)。
A.v(B)=2v(C)
B.容器内压强不再发生变化
C.容器内气体密度不再发生变化
D.A的体积分数不再变化
E.相同时间内消耗nmol的B的同时生成2nmol的D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________。
Ⅱ.上述反应适宜的温度范围是______℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________、_________和2Al + N2 ![]() 2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) 4Al(g) + 3O2(g) H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
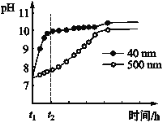
① AlN粉末水解的化学方程式是____________________________________。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在分析化学的电位法中,甘汞电极常做参比电极,它是由金属汞及其难溶盐Hg2Cl2和KCl溶液组成的电极。Hg2Cl2(甘汞)毒性较小,而HgCl2(升汞)有剧毒。
(1)K元素的基态原子的电子填充于_____个不同的能级。
(2)Hg的价层电子排布式为5d106s2,Hg元素位于元素周期表的_______区。
(3)Hg2Cl2在400~500℃时升华,由此推测Hg2Cl2的晶体类型为____。
(4)KCl和NaCl相比,____ 的熔点更高,原因是________。
(5)把NH4Cl和HgCl2按一定比例混合,在密封管中加热时,生成某种晶体,其晶胞如图所示。用X-射线衍射法测得该晶体的晶胞为长方体(晶胞参数a=b =419pm、c=794pm),每个NH4+可视为被8个Cl-围绕,距离为335pm,Cl-与Cl-尽可能远离。
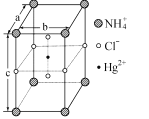
①该晶体的化学式为________。
②晶体中Cl-的空间环境_____________(填“相同”或“不相同”)。用题中数据说明理由_______________
③设阿伏加德罗常数的值为NA,则该晶体的密度为_______g/cm3(列出计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com