
【题目】某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(七水合硫酸亚铁)和胆矾晶体,以探索工业废料的再利用.其实验方案如下:试回答下列问题:

(1)写出合金溶于试剂①溶液时相关反应的离子方程式 ____________________________,操作②的名称是 ______________ 。
(2)滤液A中通入过量气体的离子反应方程式为_______________________________,由滤液A制AlCl3溶液有途径I和途径II两种,与途径I相比,途径II存在着明显的缺陷是: _________________________________________________________。
(3)溶液E中的主要溶质为 _____________________ ;如何检验滤液E是否已被氧化(写出操作过程、现象和结论) _______________________________________________。
(4)按环保要求,写出用滤渣F制备硫酸铜溶液的各步反应的化学方程式 ________。
【答案】 2Al+2OH-+2H2O=2AlO2-+3H2↑ 过滤 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 途径Ⅱ直接往溶液中加入过量的盐酸,得到的AlCl3溶液会混有其它别的氯化物 FeSO4 取少量的滤液E于试管中,滴加KSCN溶液,若溶液变成血红色,则表明已被氧化,反之则没有 2Cu+O2![]() 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
【解析】含有铝、铁、铜的合金加入足量的氢氧化钠溶解,只有铝与氢氧化钠溶液反应,所以滤渣B为铁和铜,滤液中含有偏铝酸钠与剩余的NaOH,途径Ⅰ加入足量的盐酸得到氯化铝溶液,途径Ⅱ通入二氧化碳得到氢氧化铝沉淀,氢氧化铝用盐酸溶解得到氯化铝.滤渣B中用稀硫酸溶解,Cu不溶解,过滤,滤渣F为Cu、滤液E中含有硫酸亚铁,经过加热浓缩、冷却结晶、过滤、洗涤等操作得到绿矾。粗制氧化铜反应得到硫酸铜,再经过加热浓缩、冷却结晶、过滤、洗涤等操作得到蓝矾。(1)含有铝、铁、铜的合金溶于试剂①为足量氢氧化钠溶液时,铝发生反应生成偏铝酸钠和氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,滤渣B中用稀硫酸溶解,Cu不溶解,过滤分离。(2)滤液A中通入过量气体的离子反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- ;途径Ⅱ直接往溶液中加入过量的盐酸,得到的AlCl3溶液混有氯化钠杂质,途径Ⅱ直接往溶液中加入过量的盐酸,得到的AlCl3溶液会混有其它别的氯化物,NaAlO2+4HCl=AlCl3+NaCl+2H2O。(3)滤液E中含有硫酸亚铁,硫酸亚铁被氧化为硫酸铁,利用KSCN溶液遇到铁离子会生成血红色溶液设计检验:取少量的滤液E于试管中,滴加KSCN溶液,若溶液变成血红色,则表明已被氧化,反之则没有。(4)滤渣F为Cu制备硫酸铜溶液时,利用铜和氧气反应生成氧化铜,氧化铜和硫酸反应得到硫酸铜溶液,反应的化学方程式为:2Cu+O2![]() 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.18 g H2O在标准状况下的体积是22.4 L
B.22.4 L O2中一定含有6.02×1023个氧分子
C.在标准状况时,20 mL NH3与60 mL N2所含的原子个数比为2:3
D.将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 moL/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界第一条大面积碲化镉薄膜“发电玻璃”生产线最近在成都投产,该材料是在玻璃表面镀一层碲化镉薄膜,光电转化率高。下列说法错误的是
A. 普通玻璃含有二氧化硅B. 该发电玻璃能将光能完全转化为电能
C. 碲化镉是一种无机化合物D. 应用该光电转化技术可减少温室气体排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I﹣>Fe2+ . 往100mL碘化亚铁溶液中缓慢通入3.36L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+ . 则原碘化亚铁溶液的物质的量浓度为( )
A.0.12molL﹣1
B.0.1molL﹣1
C.1.2molL﹣1
D.1.0molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,充入1mol N2 和3 mol H2,并在一定温度和压强条件下,使其发生反应:N2(g) + 3H2 (g) ![]() 2NH3(g) △H=-92.4 kJ·mol-1。
2NH3(g) △H=-92.4 kJ·mol-1。
(1)若保持容器体积不变,再向其中充入1mol N2,反应速率会_________(填“加快”、“减慢”或“不变”),理由是____________________________________________;
(2)若保持容器体积不变,再向其中充入1mol氩气,反应速率会_________(填“加快”、“减慢”或“不变”),理由是_____________________________________;
(3)若保持容器气体压强不变,再向其中充入1mol N2 和3 mol H2,反应速率会_________(填“加快”、“减慢”或“不变”),理由是___________________________________________;
(4)使用催化剂,反应速率会_________(填“加快”、“减慢”或“不变”),理由是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的决定因素是 ( )
A. 元素相对原子质量依次递增 B. 元素的最高正化合价呈周期性变化
C. 元素原子最外层电子排布呈周期性变化 D. 元素金属性或非金属性呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池的反应方程式为: 2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2,其构造如图所示。有
关说法不正确的是
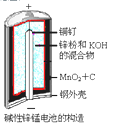
A. 负极反应式:Zn+2OH--2e-=Zn(OH)2
B. 放电时正极MnO2得到电子,发生氧化反应
C. 该电池使用一段时间后,电解液pH增大
D. 放电时,锌粉失去的电子,从负极通过外电路流向正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com