
【题目】碳原子数小于11的烷烃分子中一氯代物不存在同分异构体的有
A. 2种 B. 4种 C. 6种 D. 8种
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
【题目】甲、乙连个探究性学习小组,他们拟测定过氧化钠样品(含少量的Na2O)的纯度。
(1)甲组同学拟选用图l实验装置完成实验:

①写出实验中所发生主要反应的化学方程式____________
②该组同学必须选用的装置的连接顺序是:
A 接(____),(____)接(____), (____)接(____) (填接口字母,可不填满);
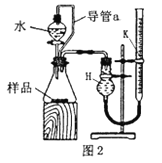
(2)乙组同学仔细分析甲组同学的实验装置后,认为:水滴入锥形瓶中,即使不生成氧气,也会将瓶内空气排出,使所测氧气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氧气体积偏小。于是他们设计了图2所示的实验装置。
①装置中导管a的作用:__________
②实验结束冷却至室温后,在读取量气管k中液面读数时,K中液面高于H中的液面,则测量结果将__________(偏高,不变或偏低),若有影响,应进行_________(操作)后再读效;
③若实验中样品的质量为mg,实验前后量气管k中液面读数分别为V0L、V1L(V0> V1换算成标况)。则样品的纯度为__________(含m、V0、V1的表达式)
(3)图2的装置可测定一定质量铜铁合金(不含其它元素)样品中铁的质量分数。分液漏斗中加入的试剂是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法错误的是
A. 明矾可用作净水剂
B. 氧化铝用于制造耐火坩埚
C. 碳酸钡可用作医疗上检查肠胃的“钡餐”
D. 常温下,可用铁制容器贮运浓硝酸、浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (普通班做)
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
平衡时,X的转化率为 ;平衡时,Y的浓度为 ;
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A容器内压强不再发生变化
B X的体积分数不再发生变化
C容器内气体原子总数不再发生变化
D相同时间内消耗2n mol的Z的同时消耗n mol的Y
E. 相同时间内消耗n mol的Y的同时消耗3n mol的X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】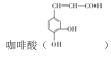 是制备某种抗肿瘤药物的重要原料。由甲苯制备咖啡酸的合成路线(部分反应条件略去)如图所示:
是制备某种抗肿瘤药物的重要原料。由甲苯制备咖啡酸的合成路线(部分反应条件略去)如图所示:

已知:
(1)咖啡酸的分子式为_____,含氧官能团有______。
(2)A的结构简式为_____,该分子的核磁共振氢谱峰面积之比为______。
(3)反应④的化学方程式为________,反应类型为_______。
(4)满足下列条件的咖啡酸的同分异构体有_____种。
①苯环上有三个取代基②1mol该物质能与2molNaHCO3反应。
(5)检验F中碳碳双键官能团的方法是_______。
(6)苯丙烯酸的结构简式为![]() ,根据提供信息ii,设计以甲苯和乙醛为原料制备苯丙烯酸的合成路线。_______
,根据提供信息ii,设计以甲苯和乙醛为原料制备苯丙烯酸的合成路线。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 糖类、油脂、蛋白质都是高分子化合物,它们水解的最终产物不相同
B. 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
C. 可用油脂的碱性水解来制备肥皂和甘油
D. 乙醇和汽油都是可再生能源,所以要大力发展“乙醇汽油”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的烧碱溶液滴定未知浓度的盐酸,下列操作中正确的是
A. 碱式滴定管用蒸馏水洗净后,直接加入已知浓度的烧碱溶液
B. 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的盐酸
C. 滴定时,没有逐出滴定管下口的气泡
D. 该实验中,某同学将消耗已知浓度的烧碱溶液的体积记录为 22.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电力工业所需的钢制构件在镀锌前需要经过酸洗,其基本原理是用盐酸除去其表面的Fe2O3·H2O及FeO等杂质。回收废酸同时生产含铁产品的流程如下:

已知:i.酸洗钢制构件后得到废酸的主要成分如下表所示。

ii pH <4时,Fe2+不易被氧气氧化。
(1)酸洗钢制构件时发生反应的离子方程式:2H++ FeO=Fe2++H2O、_______________。
(2)过程II中,发生的主要反应:FeCl2(s)十H2SO4(aq) ![]() FeSO4(s)+2HCl( aq)。
FeSO4(s)+2HCl( aq)。
①加入过量H2SO4的作用是_____________(至少写出两点)。
②用化学平衡原理解释鼓入空气的目的:_____________。
(3)过程III中,FeSO4隔绝空气焙烧得到的尾气中含有两种可用于生产硫酸的氧化物,此过程发生反应的化学方程式是_________________。
(4)过程IV发生反应的离子方程式是____________________。
(5)过程V:阴离子交换树脂可将FeCl4-选择性吸附分离,其过程可表示为ROH +X- ![]() RX +OH-。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4-
RX +OH-。当树脂吸附饱和后可直接用水洗涤树脂进行脱附,同时脱附过程发生反应:FeCl4- ![]() Fe3+ +4C1-。
Fe3+ +4C1-。
①吸附后溶液酸性下降的原因是_______________。
②洗脱液中主要含有的溶质是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿黑酸症是一种引起酪氨酸在人体内非正常代谢的遗传病,酪氨酸在体内有如下转化:

下列说法错误的是( )
A. 酪氨酸既能与盐酸反应,又能与NaOH溶液反应
B. 1mol尿黑酸与足量浓溴水反应,最多消耗3molBr2
C. 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个
D. 对羟基苯丙酮酸分子核磁共振氢谱有4个峰,有1个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com