
【题目】40℃时,在氨—水体系中不断通入CO2,各种粒子的浓度变化趋势如图所示。下列说法不正确的是
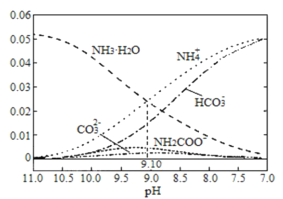
A.40℃时,K(NH3·H2O)=10-9.10
B.不同pH的溶液中均存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,![]() 不断减小
不断减小
D.随溶液pH不断降低,生成的中间产物NH2COONH4又不断转化为NH4HCO3
【答案】A
【解析】
A. 在溶液pH=9.10时c(NH4+)=c(NH3·H2O),Kb(NH3·H2O)=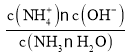 =c(OH-),由于Kw=c(H+)·c(OH-)是常数,只与温度有关,若温度为室温,则Kw=10-14,pH=9.10时,c(H+)=10-9.10,c(OH-)=
=c(OH-),由于Kw=c(H+)·c(OH-)是常数,只与温度有关,若温度为室温,则Kw=10-14,pH=9.10时,c(H+)=10-9.10,c(OH-)=![]() =10-4.9,Kb(NH3·H2O)= c(OH-)=10-4.9,升高温度,促进电解质的电离,所以温度为40℃时,K(NH3·H2O)>10-4.9,A错误;
=10-4.9,Kb(NH3·H2O)= c(OH-)=10-4.9,升高温度,促进电解质的电离,所以温度为40℃时,K(NH3·H2O)>10-4.9,A错误;
B. 溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则不同pH的溶液中存在电荷守恒关系为:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-),B正确;
C. 已知Kb=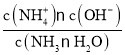 ,温度一定时,Kb为常数,随着CO2的通入,c(NH4+)逐渐增大,则
,温度一定时,Kb为常数,随着CO2的通入,c(NH4+)逐渐增大,则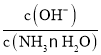 不断减小,C正确;
不断减小,C正确;
D. 由图象可知:开始溶液pH较大时没有NH2COO-,后来随着溶液pH的降低,反应产生NH2COO-,并且逐渐增多,当pH减小到一定程度NH2COO-逐渐减小直至消失,同时NH4HCO3又逐渐增多,即在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成,后NH2COO-转化为NH4HCO3,D正确;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生的污染,其工作原理如图所示。下列说法正确的是

A.NaClO4的作用是传导离子和参与电极反应
B.吸附层b的电极反应:H2-2e-+2OH-=2H2O
C.全氢电池工作时,将酸碱反应的中和能转化为电能
D.若离子交换膜是阳离子交换膜,则电池工作一段时间后左池溶液pH基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠俗称大苏打、海波,主要用作照相业定影剂,还广泛应用于鞣革、媒染、化工、医药等行业。常温下,溶液中析出晶体为Na2S2O35H2O.Na2S2O35H2O于40-45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图甲所示。
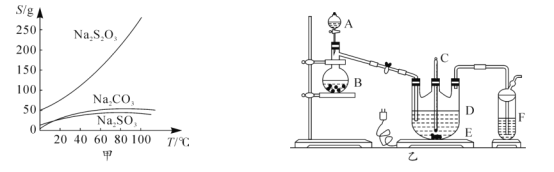
Ⅰ.制备Na2S2O35H2O
将硫化钠和碳酸钠按反应要求比例放入图乙装置D中,然后注入150mL蒸馏水使其溶解,再在分液漏斗A中注入一定浓度的H2SO4,在蒸馏烧瓶B中加入亚硫酸钠固体,并按图乙安装好装置。
(1)仪器D的名称为______
(2)打开分液漏斗活塞,注入H2SO4,使反应产生的气体较缓慢均匀地通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,总反应方程式为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。
3Na2S2O3+CO2。
①烧瓶B中发生反应的化学方程式为______。
②将B中产生的气体缓慢均匀地通入D中的正确操作是______。
③制备过程中仪器D中的溶液要控制在弱碱性条件下,其理由是______(用离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量

(3)操作I为趁热过滤,其目的是______;操作Ⅱ是过滤、洗涤、干燥,其中洗涤操作时用______(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液中有少量晶体析出为止,蒸发时控制温度不宜过高的原因是______。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,称取1.25g的粗样品溶于水,配成250mL溶液,取25.00mL溶液于锥形瓶中,滴入几滴淀粉溶液,用0.0100mol/L标准I2溶液滴定,当溶液中S2O32-全部被氧化时,消耗碘溶液的体积为25.00mL.试回答:(提示:I2+2S2O32-═2I-+S4O62-)
①达到滴定终点时的现象:______
②产品中Na2S2O35H2O的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸是有机合成中一种有用的中间体。某研究小组以丙烯醛为原料,设计了如下路线合成环丁基甲酸(部分反应条件、产物已省略)。
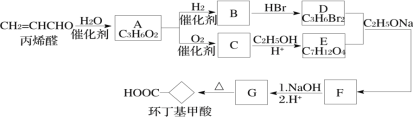
已知:
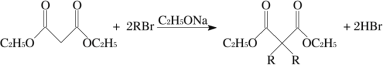
(1)
(2)![]()
请回答下列问题:
(1)由丙烯醛生成化合物A的反应类型为____________。
(2)化合物C的结构简式是________________________。
(3)下列说法中正确的是___________(填字母代号)。
A.丙烯醛可以发生银镜反应 B.化合物B和C能形成高聚物
C.化合物G的化学式为C6H8O4 D.1mol化合物B与足量金属钠反应能生成1mol氢气
(4)写出D+E→F的化学方程式:__________________________________________。
(5)符合下列条件的G的同分异构体有____________种,写出其中在1H-NMR谱上显示两组峰且面积比为3∶1的结构简式:______________________。
①能使Br2/CCl4溶液褪色;②1mol G与1mol Na2CO3反应可以生成1mol CO2
(6)以1,3-丁二烯和化合物E为原料可制备![]() ,请选用必要的试剂设计合成路线____________________。
,请选用必要的试剂设计合成路线____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中错误的是
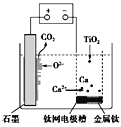
A. 在制备金属钛前后,整套装置中CaO的总量保持不变
B. 阳极的电极反应式为C+2O2--4e-===CO2↑
C. 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子
D. 若用铅蓄电池作供电电源,“—”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种除草剂,可由下列路线合成(部分反应条件略去):

(1)B和A具有相同的实验式,分子结构中含一个六元环,核磁共振氢谱显示只有一个峰,则B的结构简式为__________,A→B的反应类型是__________。
(2)C中含氧官能团的名称是__________;ClCH2COOH的名称(系统命名)是__________。
(3)D→E所需的试剂和条件是__________。
(4)F→G的化学方程式是___________________。
(5)I是E的一种同分异构体,具有下列结构特征:①苯环上只有一个取代基;②是某种天然高分子化合物水解的产物。I的结构简式是__________。
(6)设计由乙醇制备![]() 的合成路线__________(无机试剂任选)。
的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家在合成氨(N2+3H2![]() 2NH3 △H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
2NH3 △H<0)反应机理研究中取得新进展,首次报道了LiH-3d过渡金属这一复合催化剂体系,并提出了“氮转移”催化机理,如图所示。下列说法不正确的是( )
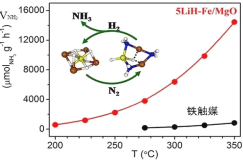
A.过程中有极性键形成
B.复合催化剂降低了反应的活化能
C.复合催化剂能降低合成氨反应的焓变
D.350℃,催化效率:5LiH-Fe/MgO>铁触媒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3.15晚会中曝光一种劣质净水机的欺骗推销手段:销售人员用如图所示“验水器”检验居民家庭自来水,接通电源后自来水产生大量深色絮状沉淀,而净化后的水再用同一个“验水器”检验,再次接通电源后水没有明显变化依然澄清透明。关于该实验下列分析正确的是( )

A.净化水导电能力理论上比自来水强
B.两次通电可能通过开关反转正负极
C.两次通电的阴极反应产生气体不同
D.金属电极可能采用的是铝或铁材质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的且操作正确的是

A. 用图a所示装置配制100mL0.100mol·L-1稀盐酸
B. 用图b所示装置蒸干FeCl3饱和溶液制备FeCl3固体
C. 用图c所示装置制取少量CO2气体
D. 用图d所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com