
【题目】如图所示的原电池装置,X、Y为两个电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列叙述正确的是
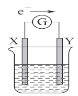
A.外电路中的电流方向为:X→外电路→Y
B.若两个电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C.若两个电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y极上发生的是氧化反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科。回答下列问题:
(1)认识仪器是正确使用仪器的前提。

写出上述仪器的名称:A___________;B__________;C_________。
(2)实验室利用胆矾晶体和烧碱制备氧化铜固体时,其实验操作如下:
Ⅰ.混合 Ⅱ.过滤 Ⅲ.加热分解 Ⅳ.溶解 Ⅴ.洗涤
就此实验完成下列填空:
①正确的操作步骤是______________(填罗马数字)。
②操作Ⅱ中用到的玻璃仪器除烧杯、玻璃棒外,还需要用到上述仪器中的________(填字母)。
③在实验中多次用到玻璃棒,其作用有三个,分别是______、_______和转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶(I)是半导体制造的一种重要材料,其中一种合成路线如下,完成下列填空。
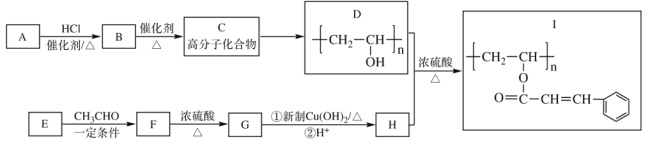
已知:![]()
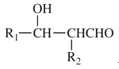
(1)A的电子式_____________,E的结构简式_____________;
(2)C→D反应的试剂和条件为_____________,F→G的反应类型_____________;
(3)D+H→I的化学反应方程式___________________________________________;
(4)H的芳香类同分异构体中,可以发生水解反应和银镜反应的有_________种;
(5)![]() 是重要的工业加工助剂,写出以乙烯和乙醛为原料制备
是重要的工业加工助剂,写出以乙烯和乙醛为原料制备![]() 的合成路线。(其它无机试剂任选),(合成路线常用的表达方式为:A
的合成路线。(其它无机试剂任选),(合成路线常用的表达方式为:A B
B 目标产物)___________________
目标产物)___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中的可逆反应:N2(g)+3H2(g)![]() 2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是
2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是
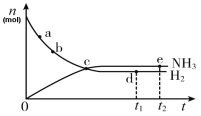
A. a点的正反应速率比b点的大B. c点处反应达到平衡
C. d点和e点处n(N2)不相等D. d点3v正(H2)= v逆(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题。该小组设计的简单实验装置如图所示:

该实验的主要操作步骤如下:
①配制100mL1.0molL﹣1的盐酸溶液;
②用_______(填仪器名称并注明规格)量取10.0mL1.0molL﹣1的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为______;
④往广口瓶中装入足量水,按如图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述实验步骤④中检查装置气密性的方法:______。
(2)实验步骤⑤中应选用______(填序号)的量筒。
A.100mL B.200mL C.500mL
读数时除恢复到室温外,还要注意______。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=______,若未除去镁条表面的氧化膜,则测量结果______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化氢转化为氯气的技术成为科学研究的热点,在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如图所示。下列说法正确的是( )
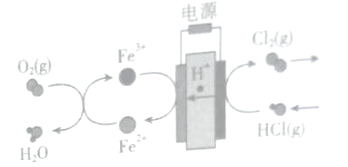
A.正极发生的电极反应为Fe3++e-=Fe2+
B.阳极反应为:2C1--2e-=Cl2↑
C.若消耗5.6L氧气,则电路中转移1mol电子
D.Fe3+在反应中起催化剂作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】误服铊盐会导致人体急性中毒,普鲁士蓝[KFe2(CN)6]可用作铊盐的解毒剂。
(1)Fe3+的价电子轨道表示式为___,与N同周期的主族元素中,第一电离能比N大的元素有___种。
(2)普鲁士蓝与硫酸作用可形成HCN,HCN的中心原子的杂化轨道类型为___,分子的立体构型是___,分子中σ键与π键数目之比为___。
(3)普鲁士蓝中的化学键不含有___(填字母)。
a.离子键
b.共价键
C.配位键
d.金属键
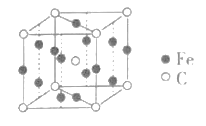
(4)已知FexCy的晶胞结构如图所示,则其化学式为___,铁原子的配位数是___。
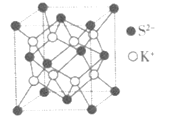
(5)如图为K2S的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是ρg·cm-3,试计算K+与S2-的最短距离为___nm(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一密闭容器中发生可逆反应:2E(g)![]() F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
F(g)+xG(g) △H<0若起始时E的浓度为amol·L-1,F、G的浓度均为0,达到平衡时E的浓度为0.5amol·L-1。若起始时E的浓度为2amol·L-1,F、G的浓度均为0,达到平衡时,下列说法正确的是
A. 升高温度时,正反应速率加快,逆反应速率减慢
B. 若x=1,容器的容积保持不变,则新平衡下E的体积分数为50%
C. 若x=2,容器的容积保持不变,则新平衡下F的平衡浓度大于0.5amol·L-1
D. 若x=2,容器内的压强保持不变,则新平衡下E的物质的量为amol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应:C(s)+![]() O2(g)=CO(g) ΔH1<0 CO(g)+
O2(g)=CO(g) ΔH1<0 CO(g)+![]() O2(g)=CO2(g) ΔH2<0 C(s)+O2(g)=CO2(g) ΔH3<0。相同条件下,下列说法正确的是( )
O2(g)=CO2(g) ΔH2<0 C(s)+O2(g)=CO2(g) ΔH3<0。相同条件下,下列说法正确的是( )
A.56 g CO和32 g O2所具有的总能量小于88 g CO2所具有的总能量
B.碳的燃烧热是|ΔH3|
C.ΔH1<ΔH3
D.28 g CO的总能量比44 g CO2的总能量高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com