
【题目】(1)从氧化还原的角度分析水在下列化学反应中只做还原剂的是_______________
A电解水 B钠和水的反应(2Na+2H2O===2NaOH+H2↑)
C氟气和水反应(2F2+2H2O===4HF+O2) D氯气和水反应(Cl2+H2O===HCl+HClO):
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是________;若反应方程式中转移了0.4 mol电子,则氧化产物的质量是_____ g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-,这个事实说明Fe2+、Cl-、Br—三种粒子还原性由强到弱的排列顺序为:__________________。
【答案】CNO6.4gFe2+>Br—>Cl-、
【解析】试题分析:(1)反应中水中元素化合价只升高时,水只做还原剂;(2) 硝酸的氧化性大于S,所以该反应中硝酸做氧化剂,反应中得电子化合价降低,氯化氢是还原剂,反应中失电子化合价升高,方程式3H2S+2HNO3=3S+2NO+4H2O,结合化合价变化计算解答;同种氧化剂先与还原性强的物质反应;
解析:(1)
电解水时,水中氢元素化合价降低、氧元素化合价升高,所以水既是氧化剂又是还原剂 ; 钠和水的反应2Na+2H2O===2NaOH+H2↑,水中氢元素化合价降低,水做氧化剂;
氟气和水反应2F2+2H2O===4HF+O2,水中氧元素化合价升高 ,水做还原剂;氯气和水反应Cl2+H2O===HCl+HClO,水中元素化合价不变,水既不是氧化剂又不是还原剂 ;(2)硝酸的氧化性大于S,所以硝酸做氧化剂,S做氧化产物,反应方程式为3H2S+2HNO3=3S+2NO+4H2O,反应中N元素化合价降低,所以NO是还原产物;氧化产物是S,电子转移的方向和数目为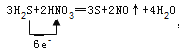 ,转移6 mol电子,生成3S,所以转移了0.4 mol电子,生成0.2mol S,质量为6.4 g;(3)还原剂的氧化性大于还原产物的还原性;根据氧化还原反应的先后规律,同种氧化剂先与还原性强的物质反应;将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,Fe2+先与Cl2反应,说明Fe2+还原性大于Br—,在2Fe2++Cl2===2Fe3++2Cl-反应中Fe2+是还原剂,Cl-是还原产物,所以还原性Fe2+还原性大于Cl-,三种粒子还原性由强到弱的排列顺序为Fe2+>Br—>Cl-。
,转移6 mol电子,生成3S,所以转移了0.4 mol电子,生成0.2mol S,质量为6.4 g;(3)还原剂的氧化性大于还原产物的还原性;根据氧化还原反应的先后规律,同种氧化剂先与还原性强的物质反应;将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,Fe2+先与Cl2反应,说明Fe2+还原性大于Br—,在2Fe2++Cl2===2Fe3++2Cl-反应中Fe2+是还原剂,Cl-是还原产物,所以还原性Fe2+还原性大于Cl-,三种粒子还原性由强到弱的排列顺序为Fe2+>Br—>Cl-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol/L稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
A. 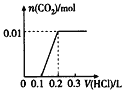 B.
B. 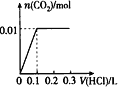
C. 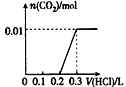 D.
D. 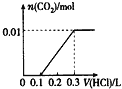
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中滴入紫色石蕊试液、硝酸银溶液,将依次观察到紫色石蕊试液先变红后退色、有白色沉淀产生等现象。这些现象与氯水所含的下列哪种微粒无直接关系?
A.HClO
B.H2O
C.Cl-
D.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:CO(g)十H2O(g)![]() CO2(g)十H2 (g)十Q(Q>0),CO和H2O浓度变化如下图:
CO2(g)十H2 (g)十Q(Q>0),CO和H2O浓度变化如下图:
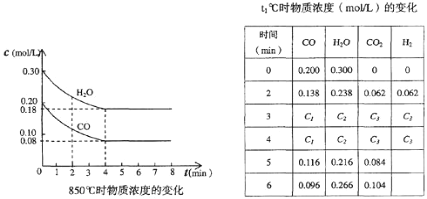
(1)则0~4 min的平均反应速率v(CO)=________mol/(L·min),该反应在850℃的平衡常数K=________
(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_________状态;C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min间,平衡向逆方向移动,可能的原因是_________(单选),表中5 min~6 min之间数值发生变化,可能的原因是_________(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜是我国制碱丁业的先驱,他根据氨碱法制碱的缺点提出用饱和的NaCl溶液、CO2、NH3反应制取纯碱的联合制碱法。某学校课外活动小组根据侯氏制碱法的原理在实验室模拟制碱。请同答下列问题:
(1)写出实验室制取NH3的化学方程式:_______________。
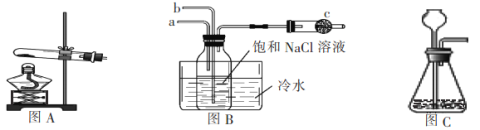
(2)上图B中的a接装置图_________(填图A或图C)
(3)用离子方程式表示装有饱和食盐水的集气瓶中的现象:______________________。
(4)水槽中的冷水的作用除了可以增加气体物质在溶液中的溶解度外还有一个重要作用是:_____________。
(5)图B中c的作用是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下2CO(g) + O2(g) = 2CO2(g) △H=-566 kJ·mol—1;CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol—1,则1molCO和3molCH4组成的混合气体在上述条件下完全燃烧放出的热量为
A.2912 kJ B.2953 kJ C.3236 kJ D.3836 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.Cl-和Cl2都有毒
B.将AgNO3溶液滴入某溶液中,若出现沉淀,则说明溶液中含有Cl-
C.将NaCl溶液滴入AgNO3溶液中或将氯气通入AgNO3溶液中均会出现白色沉淀
D.含Cl-的溶液和氯水一样均呈黄绿色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com