
| A、0.1 mol的2H35Cl分子中的中子数是2NA |
| B、标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA |
| C、铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下) |
| D、将2.24L(标准状况下)CO2通入1L 0.15 mol?L-1的NaOH溶液中,所得CO2-3和HCO-3物质的量均为0.05N |


科目:高中化学 来源: 题型:

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余.试依次写出Fe电极上可能发生的电极反应式.
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余.试依次写出Fe电极上可能发生的电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A、在830℃,等物质的量的CO和H2O反应达到平衡时,CO的转化率为50% |
| B、在500℃时,反应达到平衡后,增大压强,化学平衡常数K减小 |
| C、恒温、恒容条件下,若混合气体的平均相对分子质量一定,不能确定可逆反应是否达到平衡 |
| D、上述正向反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、活性银离子、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学核心 |
| B、肌红蛋白、蚕丝、过氧化氢酶、鱼油充分水解后均可得到氨基酸 |
| C、嫦娥三号月球车玉兔号在进入第二个月夜休眠前,出现了机构控制异常情况,其病因或为月尘,即月球上直径小于10微米的浮尘,月尘分散在空气中形成的分散系属于胶体 |
| D、某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①⑥ |
| C、③④⑤ | D、②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 mol SO2和1 mol O2 在一定条件下反应,反应后分子总数大于2NA |
| B、25℃时,在pH=2的1.0 L H2SO4溶液中含有H+数目为0.01NA |
| C、在二氧化硅的晶体中,1mol SiO2含有Si-O键数目为4NA |
| D、25mL 18 mol?L-1浓硫酸与足量Zn反应,转移电子数为0.225NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
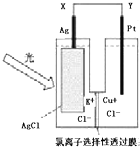 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)═AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e--→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)═AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e--→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A、光照时,电流由Y流向X |
| B、光照时,Pt电极发生的反应为2Cl-+2e-═Cl2光 |
| C、光照时,Cl-向Ag电极移动 |
| D、光照时,电池总反应为:AgCl(s)+Cu+(aq)═Ag (s)+Cu2+(aq)+Cl-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2CH3CH2OH+O2
| |||
B、CH3COOH+CH3CH2OH
| |||
C、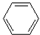 +HNO3 +HNO3
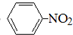 +H2O;取代反应 +H2O;取代反应 | |||
| D、CH2═CH2+Br2→CH2Br-CH2Br;加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com