
【题目】SO2是一种大气污染物,但它在化工和食品工业上却有广泛应用。某兴趣小组同学对SO2的实验室制备和性质实验进行研究。
(1)甲同学按照教材实验要求设计如图所示装置制取SO2
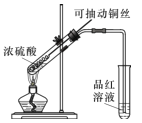
①本实验中铜与浓硫酸反应的化学方程式是 ______,铜丝可抽动的优点是_______。
②实验结束后,甲同学观察到试管底部出现黑色和灰白色固体,且溶液颜色发黑。甲同学认为灰白色沉淀应是生成的白色CuSO4夹杂少许黑色固体的混合物,其中CuSO4以白色固体形式存在体现了浓硫酸的________性。
③乙同学认为该实验设计存在问题,请从实验安全和环保角度分析,该实验中可能存在的问题是________。
(2)兴趣小组查阅相关资料,经过综合分析讨论,重新设计实验如下(加热装置略):
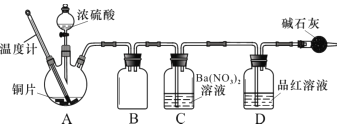
实验记录 A 中现象如下:
序号 | 反应温度/℃ | 实验现象 |
1 | 134 | 开始出现黑色絮状物,产生后下沉,无气体产生 |
2 | 158 | 黑色固体产生的同时,有气体生成 |
3 | 180 | 气体放出的速度更快,试管内溶液为黑色浑浊 |
4 | 260 | 有大量气体产生,溶液变为蓝色,试管底部产生灰白色固体,品红溶液褪色 |
5 | 300 | 同上 |
查阅资料得知: 产物中的黑色和灰白色固体物质主要成分为 CuS、Cu2S 和 CuSO4,其中CuS 和 Cu2S为黑色固体,常温下都不溶于稀盐酸,在空气中灼烧均转化为CuO和SO2。
①实验中盛装浓硫酸的仪器名称为 ____________。
②实验记录表明__________对实验结果有影响,为了得到预期实验现象,在操作上应该____________。
③装置C 中发生反应的离子方程式是 ___________________。
④将水洗处理后的黑色固体烘干后,测定灼烧前后的质量变化,可以进一步确定黑色固体中是否一定含有 CuS其原理为__________(结合化学方程式解释)。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 便于控制反应的开始与停止 吸水 无尾气吸收装置,停止加热时可能发生溶液倒吸 分液漏斗 反应温度 迅速升温至260℃ Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO↑+2SO42-+4H+ 2CuS+3O2
CuSO4+SO2↑+2H2O 便于控制反应的开始与停止 吸水 无尾气吸收装置,停止加热时可能发生溶液倒吸 分液漏斗 反应温度 迅速升温至260℃ Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO↑+2SO42-+4H+ 2CuS+3O2![]() 2CuO+2SO2、Cu2S+2O2
2CuO+2SO2、Cu2S+2O2![]() 2CuO+SO2,后一反应前后固体质量不变,因此,若煅烧后固体质量有所变化则必然存在CuS
2CuO+SO2,后一反应前后固体质量不变,因此,若煅烧后固体质量有所变化则必然存在CuS
【解析】
(1)①铜与浓硫酸反应生成硫酸铜和二氧化硫,化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,铜丝可抽动的优点是便于控制反应的开始与停止,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,铜丝可抽动的优点是便于控制反应的开始与停止,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;便于控制反应的开始与停止;
CuSO4+SO2↑+2H2O;便于控制反应的开始与停止;
②CuSO4呈白色,说明浓硫酸具有吸水性,吸收硫酸铜晶体中结晶水得到白色CuSO4,故答案为:吸水;
③二氧化硫易溶于水,有毒,污染空气,该装置中无尾气吸收装置,停止加热时可能发生溶液倒吸,故答案为:无尾气吸收装置,停止加热时可能发生溶液倒吸;
(2)①由图示知,实验中盛装浓硫酸的仪器名称为分液漏斗,故答案为:分液漏斗;
②实验记录表明温度对实验结果有影响,为了得到预期实验现象,为了防止副反应发生,在操作上应该迅速升温至260℃;故答案为:;反应温度;迅速升温至260℃;
③二氧化硫进入装置C,与硝酸钡反应生成硫酸钡沉淀、NO和硫酸,反应的离子方程式是 Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO↑+2SO42-+4H+,故答案为:Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO↑+2SO42-+4H+;
④根据反应分析,2CuS+3O2![]() 2CuO+2SO2、Cu2S+2O2
2CuO+2SO2、Cu2S+2O2![]() 2CuO+SO2,后一反应前后固体质量不变,因此,若煅烧后固体质量有所变化则必然存在CuS,故答案为:2CuS+3O2
2CuO+SO2,后一反应前后固体质量不变,因此,若煅烧后固体质量有所变化则必然存在CuS,故答案为:2CuS+3O2![]() 2CuO+2SO2、Cu2S+2O2
2CuO+2SO2、Cu2S+2O2![]() 2CuO+SO2,后一反应前后固体质量不变,因此,若煅烧后固体质量有所变化则必然存在CuS。
2CuO+SO2,后一反应前后固体质量不变,因此,若煅烧后固体质量有所变化则必然存在CuS。


科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗各类型高血压及心绞痛,其一种合成路线如下:

已知:①CH3COCH2R![]() CH3CH2CH2R
CH3CH2CH2R
② B- F苯环上均只有两个取代基
回答下列问题:
(1)A的化学名称是___,C中含氧官能团的名称是___
(2)E→F的反应类型是___,G的分子式为___。
(3)D的结构简式为___。
(4)反应B→C的化学方程式为___
(5)芳香族化合物W是G的同分异构体,W能发生水解反应,核磁共振氢谱有4组峰,峰面积之比为9:3:2:2,写出一种符合要求的W的结构简式:___.
(6)4一苄基苯酚(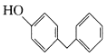 )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )

A. 1 mol甲分子内含有10 mol共价键
B. 由乙分子构成的物质不能发生氧化反应
C. 丙分子的二氯取代产物只有三种
D. 分子丁是不可能合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,国家电投集团正在建设国内首座百千瓦级铁-铬液流电池储能示范电站。铁-铬液流电池总反应为Fe2+ + Cr3+![]() Fe3 + + Cr2+,工作示意图如图。下列说法错误的是
Fe3 + + Cr2+,工作示意图如图。下列说法错误的是
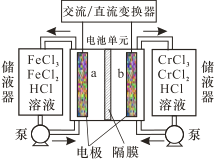
A.放电时a电极反应为 Fe 3++e- =Fe2+
B.充电时b电极反应为 Cr3++e- =Cr2+
C.放电过程中H+通过隔膜从正极区移向负极区
D.该电池无爆炸可能,安全性高,毒性和腐蚀性相对较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功研制出了具有自主知识产权的治疗缺血性脑梗死新药——丁苯酞。有机物G是合成丁苯酞的中间产物,G的一种合成路线如图:

已知:R-Br![]() R-MgBr
R-MgBr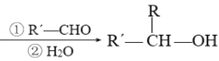
回答下列问题:
(1)A的结构简式是___,E的化学名称是___。
(2)由B生成C的化学方程式为___。
(3)G的结构简式为___。合成丁苯酞的最后一步转化为: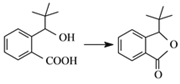 ,则该转化的反应类型是___。
,则该转化的反应类型是___。
(4)参照题中信息和所学知识,写出用![]() 和CH3MgBr为原料(其他无机试剂任选)制备
和CH3MgBr为原料(其他无机试剂任选)制备![]() 的合成路线:___。
的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适当的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
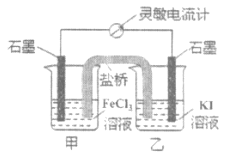
A.反应开始时,乙中电极反应为2I--2e-=I2
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.平衡时甲中溶入FeCl2固体后,电流计指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现艾滋病治疗药物利托那韦对新型冠状病毒也有很好的抑制作用,它的合成中间体2-异丙基-4-(甲基氨基甲基)噻唑可按如下路线合成:
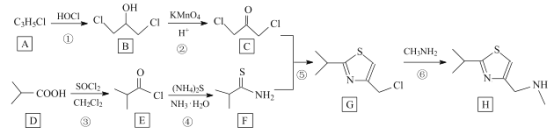
回答下列问题:
(1)A的结构简式是__________,C中官能团的名称为 ______________。
(2)①、⑥的反应类型分别是__________、_____。D的化学名称是______。
(3)E极易水解生成两种酸,写出E与NaOH溶液反应的化学方程式:_______。
(4)H的分子式为 __________________。
(5)I是相对分子质量比有机物 D 大 14 的同系物, 写出I 符合下列条件的所有同分异构体的结构简式:_____________。
①能发生银镜反应 ②与NaOH反应生成两种有机物
(6)设计由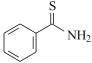 ,和丙烯制备
,和丙烯制备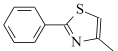 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用如下反应,可实现氯的循环利用:
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
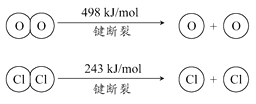
下列说法正确的是
A. 升高温度能提高HCl的转化率
B. 加入催化剂,能使该反应的焓变减小
C. 1molCl2转化为2molCl2原子放出243kJ热量
D. 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2和TiCl4均为重要的化工原料,已知:
Ⅰ.TiCl4(g)+O2(g)![]() TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
TiO2(s)+2Cl2(g) ΔH=-175.4kJ/mol
Ⅱ.2C(s)+O2(g)![]() 2CO(g) ΔH=-220.9kJ/mol
2CO(g) ΔH=-220.9kJ/mol
请回答下列问题:
(1)TiCl4(g)+2CO(g)![]() TiO2(s)+2C(s)+2Cl2(g)的ΔH=___kJ/mol。
TiO2(s)+2C(s)+2Cl2(g)的ΔH=___kJ/mol。
(2)t℃时,向10L恒容密闭容器中充入1molTiCl4和2molO2,发生反应I,4min达到平衡时测得TiO2的物质的量为0.2mol。
①反应0~4min末的平均速率v(Cl2)=_,该温度下K=_(用分数表示),O2的平衡转化率=__。
②下列措施,既能加快正反应速率,又能增大O2的平衡转化率的是_。
A.缩小容器的体积
B.加入催化剂
C.分离出部分TiO2
D.增加O2的浓度
E.减低温度
F.以上方法均不可以
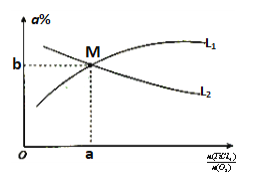
③t℃时,向10L恒容密闭容器中充入3molTiCl4和一定量的O2,发生反应I,两种气体的平衡转化率(a%)与起始的物质的量之比(TiCl4/O2)的关系如图1所示:能表示O2的平衡转化率的曲线为___(填“L1”或“L2”),M点的坐标为___(用整数或分数表示)。
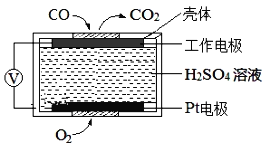
(3)CO是有毒气体,测定空气中CO含量常用的方法之一是电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为___;为减少对环境造成的影响,用CO和H2可以制备甲醇(CH3OH),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中溶质的主要成分是___(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com