
【题目】
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ______。
A.C(s)+H2O(g)═CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H<0
C.2H2(g)+O2(g)═2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为 。
(3)电解原理在化学工业中有着广泛的应用.现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y均为惰性电极,则: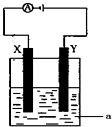
①若a为CuSO4溶液,则电解时的化学反应方程式为 .通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 。
【答案】
(1)C
(2)H2+2OH--2e-=2H2O
(3)2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4,0.4mol
2Cu+O2↑+2H2SO4,0.4mol
【解析】(1)能设计成原电池的反应通常是放热反应,同时也必须是氧化还原反应。氢气和氧气反应生成水的反应是一个放热的氧化还原反应,所以在理论上可以设计成原电池,选C。
(2)以KOH溶液为电解质溶液,可以设计一个氢氧燃料电池,其负极上氢气发生氧化反应,电极反应式为 H2+2OH--2e-=2H2O 。(3)①若a为CuSO4溶液,则电解时,阳极上发生2 H2O-4e-=O2↑+4H+,阴极上发生Cu2++2 e-=Cu,总反应的化学反应方程式为2CuSO4+2H2O ![]() 2Cu+O2↑+2H2SO4.由电极反应式可知,n(e-)=n(H+),通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH。因为0.2molCuO可以与0.4mol H+反应,所以电解过程中转移的电子的物质的量为0.4mol 。
2Cu+O2↑+2H2SO4.由电极反应式可知,n(e-)=n(H+),通电一段时间后,向所得溶液中加入0.2molCuO粉末,恰好恢复电解前的浓度和pH。因为0.2molCuO可以与0.4mol H+反应,所以电解过程中转移的电子的物质的量为0.4mol 。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 , 电解质为KOH溶液。某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题: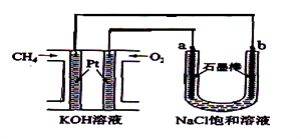
(1)甲烷燃料电池负极的电极反应为:。
(2)b电极上得到的气体是 , 电解氯化钠溶液的总反应方程式为 。
(3)若甲烷通入量为1 L(标准状况),且反应完全,则最多能产生的氯气体积为L(标准状况)。
(4)以甲醇(CH3OH)为燃料的电池中,电解质溶液为碱性,则负极的电极反应为:负极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,用甲酸提供氢气的燃料电池由瑞士科技工作者开发成功。燃料电池包括两个部分:甲(HYFORM)中使用钌(Ru)基催化剂从甲酸中产生氢气;乙(PEMFC)是以NaOH为电解质的氢氧燃料电池。装置的原理示意图如图。下列有关说法错误的是( )

A. 该燃料电池使用的甲酸比氢气更易储存和运输
B. Y室的电极反应式:O2+4H++4e-=2H2O
C. X室为负极室,Y室为正极室
D. 甲中消耗1mol甲酸,乙中转移2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应KClO3+6HCl=KCl+3Cl2↑+2H2O的说法不正确的是( )
A.KClO3是氧化剂
B.H2O既不是氧化产物也不是还原产物
C.HCl是还原剂
D.KCl既是还原产物也是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是( )
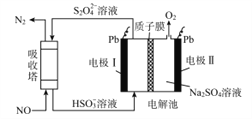
A. 吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
B. 电解池中质子从电极I向电极Ⅱ作定向移动
C. 电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
D. 每处理1 mol NO电解池质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒
B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢
D.空气、氮气、胆矾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com