
【题目】乙酸乙酯是无色、具有果香气味的液体,沸点为77.2 ℃。某同学采用14.3 mL乙酸、23 mL 95%的乙醇、浓硫酸、饱和Na2CO3溶液及极易与乙醇结合的CaCl2溶液制备乙酸乙酯,其实验装置如图所示(烧杯、部分夹持装置、温度计已略去)。
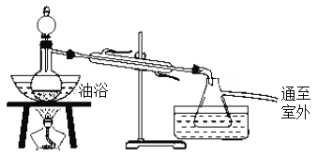
实验步骤:
①先向蒸馏烧瓶中加入乙醇,边振荡边慢慢加入浓硫酸和乙酸。此时分液漏斗中两种有机物的物质的量之比约为5:7。
②加热保持油浴温度为135~145℃。
③将分液漏斗中的液体慢慢滴入蒸馏烧瓶中,调节加料速率使蒸出乙酸乙酯的速率与进料速率大体相等,直到加料完毕。
④保持油浴温度至不再有液体流出后,停止加热。
⑤取带有支管的锥形瓶,将一定量的饱和Na2CO3溶液分批、少量、多次地加入馏出液中,边加边振荡至无气泡产生。
⑥将步骤⑤中的液体混合物分液,弃去水层。
⑦将适量饱和CaCl2溶液加入分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗中得到初步提纯的乙酸乙酯粗产品。
试回答下列问题:
(1)实验中加入浓硫酸的主要作用是__________。
(2)使用过量乙醇的主要目的是__________。
(3)使用饱和Na2CO3溶液洗涤馏出液的目的是__________。如果用NaOH浓溶液代替饱和Na2CO3溶液,引起的后果是__________。
(4)步骤⑦中加入饱和CaCl2溶液的目的是__________。
(5)步骤③中要使加料速率与蒸出乙酸乙酯的速率大致相等的原因是__________。
(6)步骤⑧中所得的粗产品中还含有的杂质是__________。
【答案】作催化剂和吸水剂促使平衡向生成乙酸乙酯的方向移动,有利于提高乙酸的转化率除去乙酸乙酯中的乙醇,中和乙酸乙酯中的乙酸,减小乙酸乙酯的溶解度使乙酸乙酯完全水解除去乙酸乙酯中的乙醇让产生的乙酸乙醋及时蒸馏出来,使蒸馏烧瓶内压强一定,从而得到平稳的蒸气气流水
【解析】
(1)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水有利于平衡向生成乙酸乙酯方向移动,因此浓硫酸的作用为催化剂,吸水剂;
(2))乙酸与乙醇发生酯化反应,该反应属于可逆反应,过量乙醇可以使平衡正向移动,增加乙酸乙酯的产率,有利于乙酸乙酯的生成;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;由于乙酸乙酯在强碱性条件下发生水解反应,如果用NaOH浓溶液代替饱和Na2CO3溶液,引起的后果是使乙酸乙酯完全水解;
(4)根据已知信息可知饱和CaCl2溶液可以吸收乙酸乙酯中可能残留的乙醇,这样分离出的粗酯中只含有水;
(5)加料与馏出的速度大致相等,可让产生的乙酸乙酯及时蒸馏出来,保持蒸馏烧瓶中压强一定,得到平稳的蒸气气流;
(6)饱和碳酸钠溶液除掉了乙酸和乙醇,饱和CaCl2溶液可以吸收乙酸乙酯中可能残留的乙醇,这样分离出的粗酯中只含有水了。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.Fe的摩尔质量是56g/mol
B.0.1mol/LKCl溶液中含有0.1molK+
C.1molN2中含有的原子数约为6.02×1023
D.常温常压下,1molCO的体积是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是较早使用的一种解热镇痛药,可由苯胺和乙酸反应制备:
![]()
已知:① 苯胺易被氧化;
② 乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3 ℃ | 305 ℃ | 0.46 |
苯胺 | -6 ℃ | 184.4℃ | 3.4 |
醋酸 | 16.6 ℃ | 118 ℃ | 易溶 |
实验步骤如下:

步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照右图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
请回答下列问题:
(1)步骤1中加入锌粉的作用是________________ 、起着沸石的作用。
(2)步骤2中控制温度计示数约105 ℃,接引管流出的主要物质是________________,若温度过高,会导致________________。刺形分馏柱中,由下到上,温度逐渐________________(填“升高”、“降低”或“不变”)。
(3)步骤3中抽滤装置所包含的仪器除减压系统外,还有吸滤瓶、________________(填仪器名称)。
(4)步骤3得到的粗产品可采取重结晶的方法进一步提纯,操作步骤是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将一定量的CH4与水蒸气通入2L的恒容密闭容器中发生反应,5min后达到平衡,各物质的物质的量随时间变化的曲线如图所示,该反应的化学方程式为_________________(物质X要求用相应物质的化学式表示),0~5min内用H2表示的反应速率v=_______,平衡时与起始时的压强之比为__________________。
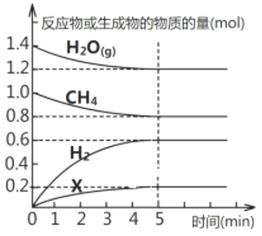
(2)下列说法能说明该反应已达到平衡状态的是___________________。
A.体系的压强不再发生变化 B.生成1mol CH4的同时消耗3mol H2
C.各组分的物质的量浓度不再改变 D.体系的密度不再发生变化
E.c(H2):c(X)=3:1且不再变化 F.v正(H2O)=3v逆(H2)
(3)能够加快该反应的措施有______________________(任写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三支试管中分别加入2 mL 5%H2O2溶液,再在其中两支试管中分别滴加0.1 mol/L FeCl3溶液和0.1 mol/L CuSO4溶液,试管中发生反应的化学方程式__________,后两支试管中能观察到的共同的明显现象是__________。该实验说明催化剂能加快化学反应速率,还能得出的结论是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:
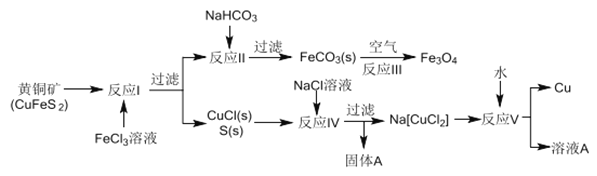
(1)黄铜矿中Cu 的化合价是______,反应I中65gFeC13 可氧化________mol CuFeS2。
(2)工业生产中的过滤操作多采用倾析法分离出固体物质,下列适合用倾析法的有______。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)在反应Ⅱ中,计算NaHCO3饱和溶液(其中CO32-平衡浓度为1.2×10-3mol/L)可产生FeCO3沉淀时的最小Fe2+浓度是_________(己知FeCO3的Ksp=3.0×10-11)
(4)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式_________________。
(5)固体物质A的成分________(写名称)。
(6)潮湿的FeCO3固体若不及时灼烧处理会在空气中逐渐变红,写出相关的化学方程式:_______________。
(7)本流程中可实现循环使用的物质除了水外,还有_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是检验气体性质的一种实验装置,请回答:

(1)当X为二氧化硫气体,Y为碳酸钠溶液时,可观察到有气泡放出,此实验现象说明二氧化硫的水溶液具有_____性。
(2)当X为二氧化硫气体,Y为品红溶液时,可观察到的现象是_______,此实验现象说明二氧化硫的水溶液具有_______性,反应后将试管中的溶液加热煮沸一段时间,可观察到的现象是_______。
(3)若让你设计一个吸收尾气的装置,试着画出装置图并注明需要的药品_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能量转换的认识中不正确的是
A. 电解水生成氢气和氧气时,电能转化成化学能
B. 白炽灯工作时电能全部转变成光能
C. 电池将化学能转化为电能
D. 煤燃烧时化学能主要转变成热能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com