
【题目】下列说法正确的是( )
A.Fe的摩尔质量是56g/mol
B.0.1mol/LKCl溶液中含有0.1molK+
C.1molN2中含有的原子数约为6.02×1023
D.常温常压下,1molCO的体积是22.4L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】沉淀碳酸钙主要用于食品、医药等行业。以精选石灰石(含有少量MgCO3、FeCO3杂质)为原料制备沉淀碳酸钙的工艺流程如下:

(1)流程中可以循环利用的物质有气体Ⅰ、气体Ⅱ和__________(填化学式)。
(2)“碳化”时发生反应的离子方程式为________________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________________。
(3)工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:

①电解过程中,加入氯化钙的目的是________________。
②石墨电极发生的电极反应方程式为________________。
③电解得到的Na中约含1%的Ca,除去其中少量Ca的方法为________________。
已知部分物质的熔沸点如下表:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种简单易行、行之有效的科学方法,人们在认识事物时可以采取多种分类方法.下列关于“H2CO3”的分类不正确的是( )
A.二元酸
B.强电解质
C.含氧酸
D.弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是无色、具有果香气味的液体,沸点为77.2 ℃。某同学采用14.3 mL乙酸、23 mL 95%的乙醇、浓硫酸、饱和Na2CO3溶液及极易与乙醇结合的CaCl2溶液制备乙酸乙酯,其实验装置如图所示(烧杯、部分夹持装置、温度计已略去)。
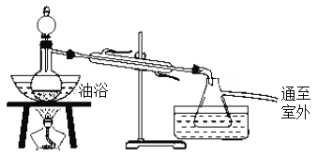
实验步骤:
①先向蒸馏烧瓶中加入乙醇,边振荡边慢慢加入浓硫酸和乙酸。此时分液漏斗中两种有机物的物质的量之比约为5:7。
②加热保持油浴温度为135~145℃。
③将分液漏斗中的液体慢慢滴入蒸馏烧瓶中,调节加料速率使蒸出乙酸乙酯的速率与进料速率大体相等,直到加料完毕。
④保持油浴温度至不再有液体流出后,停止加热。
⑤取带有支管的锥形瓶,将一定量的饱和Na2CO3溶液分批、少量、多次地加入馏出液中,边加边振荡至无气泡产生。
⑥将步骤⑤中的液体混合物分液,弃去水层。
⑦将适量饱和CaCl2溶液加入分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗中得到初步提纯的乙酸乙酯粗产品。
试回答下列问题:
(1)实验中加入浓硫酸的主要作用是__________。
(2)使用过量乙醇的主要目的是__________。
(3)使用饱和Na2CO3溶液洗涤馏出液的目的是__________。如果用NaOH浓溶液代替饱和Na2CO3溶液,引起的后果是__________。
(4)步骤⑦中加入饱和CaCl2溶液的目的是__________。
(5)步骤③中要使加料速率与蒸出乙酸乙酯的速率大致相等的原因是__________。
(6)步骤⑧中所得的粗产品中还含有的杂质是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法。
(1)目前,应用最广泛的烟气氮氧化物脱除技术是NH3催化还原法,化学反应可表示为:2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) △H<0
①该反应中,反应物总能量_____(填“>”、“<”或“=”)生成物总能量。
②当该反应有2mol N2(g)生成时,转移电子的物质的量为____________mol。
③该反应中,还原剂为_____________(填化学式),氧化产物与还原产物的质量比为______________。
(2)也可以利用甲烷催化还原氮氧化物.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ/mol
则CH4(g)将NO(g)还原为N2(g)的热化学方程式是_________________________________。
(3)还可利用ClO2消除氮氧化物的污染,反应过程如下(部分反应物或生成物略去):
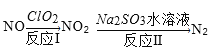
反应I的产物中还有两种强酸生成,且其中一种强酸为硝酸,且硝酸与NO2物质的量相等,则化学反应方程式为______,反应中若生成22.4L N2(标准状况),则消耗ClO2______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com