
【题目】乙酰苯胺是较早使用的一种解热镇痛药,可由苯胺和乙酸反应制备:
![]()
已知:① 苯胺易被氧化;
② 乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质 | 熔点 | 沸点 | 溶解度(20 ℃) |
乙酰苯胺 | 114.3 ℃ | 305 ℃ | 0.46 |
苯胺 | -6 ℃ | 184.4℃ | 3.4 |
醋酸 | 16.6 ℃ | 118 ℃ | 易溶 |
实验步骤如下:

步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照右图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
请回答下列问题:
(1)步骤1中加入锌粉的作用是________________ 、起着沸石的作用。
(2)步骤2中控制温度计示数约105 ℃,接引管流出的主要物质是________________,若温度过高,会导致________________。刺形分馏柱中,由下到上,温度逐渐________________(填“升高”、“降低”或“不变”)。
(3)步骤3中抽滤装置所包含的仪器除减压系统外,还有吸滤瓶、________________(填仪器名称)。
(4)步骤3得到的粗产品可采取重结晶的方法进一步提纯,操作步骤是________________。
【答案】 防止苯胺被氧化 水 未反应的醋酸蒸出 降低 布氏漏斗 将粗产品在较高温度下溶解形成浓溶液,降温结晶,过滤,洗涤,重复2~3次
【解析】(1)苯胺易被氧化,加入锌粉,防止苯胺被氧化,同时起着沸石的作用,防止暴沸;(2)已知醋酸的沸点为118℃,水的沸点为100℃,选择控制温度计约105℃,接引管流出的主要物质是水;若温度过高,会导致未反应的醋酸蒸出,降低反应物的利用率;刺形分馏柱中,由下到上,温度逐渐降低;(3)步骤3中抽滤装置所包含的仪器除减压系统外,还有吸滤瓶、布氏漏斗;(4)步骤3得到的粗产品可采取重结晶的方法进一步提纯,操作步骤是将粗产品在较高温度下溶解形成浓溶液,降温结晶,过滤,洗涤,重复2~3次。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】(F)是重要的医药中间体,其制备流程如图的所示:

已知: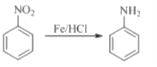
回答下列问题:
(1)B的名称是___________,F中官能团的名称为___________。
(2)写出符合下列条件B的同分异构体的结构简式___________。
a.苯环上只有两个取代基且互为邻位
b.既能发生银镜反应又能发生水解反应
(3)该流程未采用甲苯直接硝化的方法制备B,而是经由①②③三步反应制取B,其目的是_______________。
(4)写出⑥的化学反应方程式_____________________________________。
(5)写出⑧的反应试剂和条件__________________________。
(6)以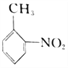 合成
合成 的流程:___________________________________________。
的流程:___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀碳酸钙主要用于食品、医药等行业。以精选石灰石(含有少量MgCO3、FeCO3杂质)为原料制备沉淀碳酸钙的工艺流程如下:

(1)流程中可以循环利用的物质有气体Ⅰ、气体Ⅱ和__________(填化学式)。
(2)“碳化”时发生反应的离子方程式为________________,该过程中通入气体Ⅰ和气体Ⅱ的顺序是________________。
(3)工业上常用电解氯化钠和氯化钙熔融物来制备金属钠,原理如下图所示:

①电解过程中,加入氯化钙的目的是________________。
②石墨电极发生的电极反应方程式为________________。
③电解得到的Na中约含1%的Ca,除去其中少量Ca的方法为________________。
已知部分物质的熔沸点如下表:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,在某含有Fe3+和Cu2+的溶液中,c(Fe3+)为4.0×10-8mol·L-1现向该溶液中滴加氨水,当开始出现氢氧化铁沉淀时,溶液的pH及溶液中允许的最大c(Cu2+)为
A. 10 2.2 mol·L-1 B. 4 2.2×10-1 mol·L-1
C. 4 2.2 mol·L-1 D. 10 2.2×10-1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是无色、具有果香气味的液体,沸点为77.2 ℃。某同学采用14.3 mL乙酸、23 mL 95%的乙醇、浓硫酸、饱和Na2CO3溶液及极易与乙醇结合的CaCl2溶液制备乙酸乙酯,其实验装置如图所示(烧杯、部分夹持装置、温度计已略去)。
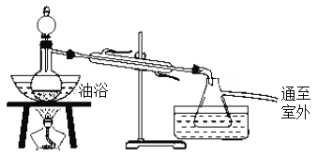
实验步骤:
①先向蒸馏烧瓶中加入乙醇,边振荡边慢慢加入浓硫酸和乙酸。此时分液漏斗中两种有机物的物质的量之比约为5:7。
②加热保持油浴温度为135~145℃。
③将分液漏斗中的液体慢慢滴入蒸馏烧瓶中,调节加料速率使蒸出乙酸乙酯的速率与进料速率大体相等,直到加料完毕。
④保持油浴温度至不再有液体流出后,停止加热。
⑤取带有支管的锥形瓶,将一定量的饱和Na2CO3溶液分批、少量、多次地加入馏出液中,边加边振荡至无气泡产生。
⑥将步骤⑤中的液体混合物分液,弃去水层。
⑦将适量饱和CaCl2溶液加入分液漏斗中,振荡一段时间后静置,放出水层(废液)。
⑧分液漏斗中得到初步提纯的乙酸乙酯粗产品。
试回答下列问题:
(1)实验中加入浓硫酸的主要作用是__________。
(2)使用过量乙醇的主要目的是__________。
(3)使用饱和Na2CO3溶液洗涤馏出液的目的是__________。如果用NaOH浓溶液代替饱和Na2CO3溶液,引起的后果是__________。
(4)步骤⑦中加入饱和CaCl2溶液的目的是__________。
(5)步骤③中要使加料速率与蒸出乙酸乙酯的速率大致相等的原因是__________。
(6)步骤⑧中所得的粗产品中还含有的杂质是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答:
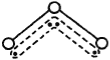
O3的分子结构
(1)臭氧与氧气的关系是___________。
(2)选出下列分子中与O3分子属于等电子体的是 。
A.H2O B.CO2 C.SO2 D.BeCl2
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有_______ 对孤对电子。
(4)O3与O2间的转化是否为氧化还原反应___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将氨气通入水中,发生化学反应的方程式有_______;下列有关分析中正确的是_______;
A.常温时氨气易溶于水
B.通常情况下氨气在水中的溶解度不大
C.溶于水的氨气分子有少量发生电离
D.氨水中的NH3H2O可电离出少量OH-
E.氨本身具有弱碱性
F.在饱和氨水中含量最多的溶质是NH3H2O
(2)氨水有许多用途,请任写一个用氨水制取不溶性碱的方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com