
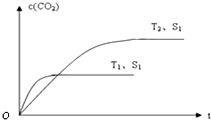
 氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法.用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO?2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法.用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO?2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:| 时间(s) | 0 | 2 | 4 |
| c(NO) ( mol?L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
| c(CO) ( mol?L-1) | 3.60×10-3 | c′ | 2.70×10-3 |
| 9.9×10-4mol/L |
| 4s |
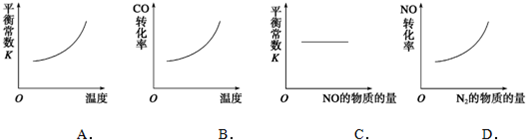
 ,故答案为:
,故答案为: ;
;

 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
| A、工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g),选取适宜的温度,使K成蒸汽从反应混合物中分离出来 |
| B、开启啤酒瓶时,有大量泡沫状气泡涌出瓶口 |
| C、工业合成氨气,采用铁触媒,并在500℃进行反应 |
| D、对于2HI(g)?H2(g)+I2(g);△H>0,升高温度可使颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
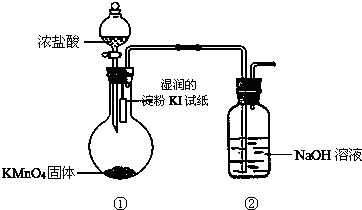
查看答案和解析>>
科目:高中化学 来源: 题型:
 在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:
在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
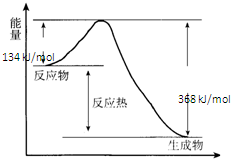 在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.
在400℃、101kPa时,NO2(g)+CO(g)=NO(g)+CO2(g)反应过程的能量变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com