
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11。室温下向10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液。如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )

A.A点所示溶液的c(H+)=5.6×10-11
B.B点所示溶液:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)=0.05mol/L
C.A点→B点发生反应的离子方程式为CO32-+H+=HCO3-
D.分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成
【答案】B
【解析】
A.A点c(HCO3-)=c(CO32-),Ka2=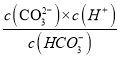 =5.6×10-11,则c(H+)=5.6×10-11mol/L,故A正确;
=5.6×10-11,则c(H+)=5.6×10-11mol/L,故A正确;
B.室温下向10mL 0.1mo1L-1Na2CO3溶液中逐滴加入0.1mo1L-1HCl溶液,B点溶液中钠离子的物质的量浓度是含碳粒子的浓度的2倍,即c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3),故B错误;
C.A点→B:CO32-逐渐减少,HCO3-逐渐增加,所以发生反应的离子方程式为CO32-+H+═HCO3-,故C正确;
D.Na2CO3溶液中逐滴加入HCl,用酚酞作指示剂,滴定产物是NaHCO3,用甲基橙作指示剂滴定时NaHCO3与HCl反应产物是H2CO3,所以分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】实验过程中,下列溶液的导电能力变化不大的是
A. ![]() 溶液中滴入
溶液中滴入![]() 溶液至过量
溶液至过量
B. 醋酸溶液中滴入氨水至过量
C. 澄清石灰水中通入![]() 至过量
至过量
D. ![]() 溶液中加入适量的NaOH固体
溶液中加入适量的NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下10mL浓度均为0.1mol·L-1的HX和HY两种一元酸溶液加水稀释过程中的pH随溶液体积变化曲线如图所示。则下列说法不正确的是

A. 电离常教:K(HX)<K(HY)
B. 浓度均为0.1mol·L-1的HX和HY的混合溶液中:c(X-)+c(HX)=c(Y-)+ c(HY)
C. 浓度均为0.1mol·L-1的NaX和NaY的混合溶液中:c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+)
D. a点水的电离度大于b点水的电离度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如下所示。
达到平衡,正反应速率随时间变化的示意图如下所示。
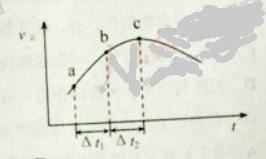
A. 反应在c 点达到平衡状态
B. 反应物浓度:![]() 点小于
点小于![]() 点
点
C. 反应物的总能量低于生成物的总能量
D. ![]() 时,SO2的转化率:
时,SO2的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
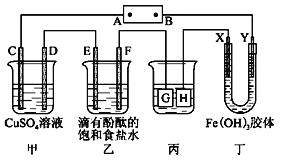
请回答:(1)B极是电源的___极,电极C的电极反应式为:___。
(2)若C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为___。
(3)现用丙装置给铜件镀银,则H电极材料是___(填“铜”或“银”),电镀液是___溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为___。
(4)一段时间后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明__在电场作用下向Y极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
C.已知乙醇和乙烯的燃烧热分别为1366.8kJ·mol-1和1411.0kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:CH2=CH2(g)+H2O(l)=C2H5OH(l) ΔH=-44.2kJ·mol-1
D.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3kJ/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫、氮单质及其化合物的叙述正确的是( )
A.SO2、NO2均为酸性氧化物
B.“雷雨肥庄稼”与氮的固定有关
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.亚硫酸钠可长期暴露在空气中,不易变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为___,盐桥中K+移向___(填“装置B”或“装置C”)。
(2)装置A中总反应的离子方程式为___。
(3)若装置E中的目的是在Cu材料上镀银,则X为___,极板N的材料为___。
(4)装置D中右侧石墨电极反应式为:___;
(5)某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如图所示,当该装置工作时,按要求填空:
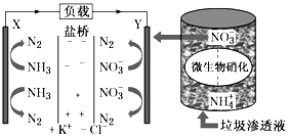
①电流由极___(填“X→Y”或“Y→X”),当电路中流过7.5mol电子时,共产生标准状况下N2的体积为___;
②Y极发生的反应为:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com