
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ/mol
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
C.已知乙醇和乙烯的燃烧热分别为1366.8kJ·mol-1和1411.0kJ·mol-1,则乙烯水化制乙醇的热化学方程式为:CH2=CH2(g)+H2O(l)=C2H5OH(l) ΔH=-44.2kJ·mol-1
D.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3kJ/mol)
【答案】C
【解析】
A.燃烧热是指在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,所以应该是生成液态水,而不是气态,故A错误;
B.氮气和氢气合成氨的反应为可逆反应,根据题目所给信息可知生成2mol氨气时放出的热量应大于38.6kJ,故B错误;
C.乙醇和乙烯的燃烧热分别为1366.8kJ·mol-1和1411.0kJ·mol-1,则:
①C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)ΔH =-1366.8kJmol-1 ;
②CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(l)ΔH =-1411.0 kJmol-1;
则乙烯水化制乙醇的热化学方程式依据盖斯定律②-①得到热化学方程式为:CH2=CH2(g)+H2O(l)=C2H5OH(l),ΔH =-44.2kJmol-1,故C正确;
D.在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时所释放的热量叫做中和热,由于生成硫酸钙微溶放热,所以H2SO4和Ca(OH)2反应的中和热△H不是(-57.3kJ/mol),也不是2×(-57.3kJ/mol),故D错误;
综上所述答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:
A. 该溶液的pH=4 B. 升高温度,溶液的pH增大 C. 此酸的电离平衡常数约为1×10-7 D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某含镍废料(主要成分为NiO,还含有少量FeO、Fe2O3、CoO、SiO2)为原料制备NixOy和碳酸钴的工艺流程如下:
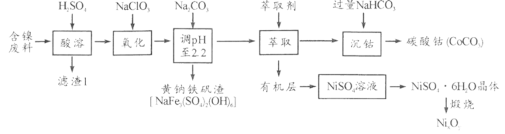
(1)“酸溶”时需将含镍废料粉碎,目的是_________________________________;“滤渣Ⅰ”主要成分为____________________(填化学式)。
(2)“氧化”中添加NaClO3的作用是_______________________,为证明添加NaClO3已足量,可用_______________(写化学式)溶液进行检验。
(3)“调pH”过程中生成黄钠铁钒沉淀,其离子方程式为__________________。
(4)“沉钴”过程的离子方程式________________________。若“沉钴”开始时c(Co2+)=0.10 mol/L,则控制pH≤_____________时不会产生Co(OH)2沉淀。(已知Ksp[Co(OH)2]=4.0×10-15,lg2=0.3)
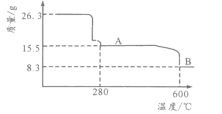
(5)从NiSO4溶液获得NiSO4·6H2O晶体的操作依次是:加热浓缩溶液至有晶膜出现,______________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中B段所表示氧化物的化学式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇在生产生活中有着广泛的用途。
(1)乙醇的官能团是_______。
(2)工业生产中,用乙烯与水反应制得乙醇,该反应类型为_________。
(3)乙醇与乙酸反应可制得香料乙酸乙酯,乙酸乙酯的结构简式为___________。
(4)乙醇在铜作催化剂条件下可被氧化为乙醛,写出反应的化学方程式__________。
(5)交警常使用酒精检测仪来检验机动车司机是否酒驾,其原理是:司机口中呼出的乙醇可以使检测仪中的橙色重铬酸钾(K2Cr2O7)转变为绿色的硫酸铬[Cr2(SO4)3],上述反应涉及的乙醇性质有________。
A.无色液体 B.密度比水的小 C.易挥发 D.具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11。室温下向10mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/LHCl溶液。如图是溶液中含碳元素微粒物质的量分数随pH降低而变化的图象(CO2因有逸出未画出).下列说法错误的是( )

A.A点所示溶液的c(H+)=5.6×10-11
B.B点所示溶液:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)=0.05mol/L
C.A点→B点发生反应的离子方程式为CO32-+H+=HCO3-
D.分步加入酚酞和甲基橙,用滴定法可测定Na2CO3与NaHCO3混合物的组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在不同情况下测得化学反应速率,其中最快的是
2C(g)+2D(g)在不同情况下测得化学反应速率,其中最快的是
A.v(D)=0.4mol/(L·S)B.v(C)=0.5mol/(L·S)
C.v(B)=0.6mol/(L·S)D.v(A)=0.15mol/(L·S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小分子抗癌药物的分子结构如右图所示,下列说法正确的是( )

A.1mol该有机物最多可以和5mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水或氢气反应,最多消耗3mol Br2或6molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com